Этиловый спирт или винный является широко распространённым представителем спиртов. Известно много веществ, в состав которых наряду с углеродом и водородом входит кислород. Из числа кислородсодержащих соединений мне интересен прежде всего класс спиртов.
Этиловый спирт
Физические свойства спирта . Этиловый спирт С 2 Н 6 О - бесцветная жидкость со своеобразным запахом, легче воды (удельный вес 0,8), кипит при температуре 78°,3, хорошо растворяет многие неорганические и органические вещества. Спирт «ректификат» содержит 96% этилового спирта и 4% воды.
Строение молекулы спирта .Согласно валентности элементов, формуле С 2 Н 6 О соответствуют две структуры:
Чтобы решить вопрос о том, какая из формул соответствует спирту в действительности, обратимся к опыту.
Поместим в пробирку со спиртом кусочек натрия. Тотчас начнётся реакция, сопровождающаяся выделением газа. Нетрудно установить, что этот газ - водород.
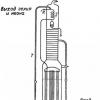
Теперь поставим опыт так, чтобы можно было определить, сколько атомов водорода выделяется при реакции из каждой молекулы спирта. Для этого в колбу с мелкими кусочками натрия (рис. 1) прибавим по каплям из воронки определённое количество спирта, например 0,1 грамм-молекулы (4,6 грамма). Выделяющийся из спирта водород вытесняет воду из двугорлой склянки в измерительный цилиндр. Объём вытесненной воды в цилиндре соответствует объёму выделившегося водорода.

Рис.1. Количественный опыт получения водорода из этилового спирта.
Так как для опыта была взята 0,1 грамм-молекулы спирта, то водорода удаётся получить (в пересчёте на нормальные условия) около 1,12 литра. Это означает, что из грамм-молекулы спирта натрий вытесняет 11,2 литра , т.е. половину грамм-молекулы, иначе говоря 1 грамм-атом водорода. Следовательно, из каждой молекулы спирта натрием вытесняется только один атом водорода.
Очевидно, в молекуле спирта этот атом водорода находится в особом положении по сравнению с остальными пятью атомами водорода. Формула (1) не даёт объяснения такому факту. Согласно ей, все атомы водорода одинаково связаны с атомами углерода и, как нам известно, не вытесняются металлическим натрием (натрий хранят в смеси углеводородов - в керосине). Наоборот, формула (2) отражает наличие одного атома, находящегося в особом положении: он соединён с углеродом через атом кислорода. Можно заключить, что именно этот атом водорода связан с атомом кислорода менее прочно; он оказывается более подвижным и вытесняется натрием. Следовательно, структурная формула этилового спирта:

Несмотря на большую подвижность атома водорода гидроксильной группы по сравнению с другими атомами водорода, этиловый спирт не является электролитом и в водном растворе не диссоциирует на ионы.

Чтобы подчеркнуть, что в молекуле спирта содержится гидроксильная группа - ОН, соединённая с углеводородным радикалом, молекулярную формулу этилового спирта пишут так:

Химические свойства спирта . Выше мы видели, что этиловый спирт реагирует с натрием. Зная строение спирта, мы можем эту реакцию выразить уравнением:

Продукт замещения водорода в спирте натрием носит название этилата натрия. Он может быть выделен после реакции (путём испарения избытка спирта) в виде твёрдого вещества.
При поджигании на воздухе спирт горит синеватым, еле заметным пламенем, выделяя много тепла:

Если в колбе с холодильником нагревать этиловый спирт с галогеноводородной кислотой, например с НВг (или смесью NаВг и Н 2 SО 4 , дающей при реакции бромистый водород), то будет отгоняться маслянистая жидкость - бромистый этил С 2 Н 5 Вг:

Эта реакция подтверждает наличие гидроксильной группы в молекуле спирта.
При нагревании с концентрированной серной кислотой в качестве катализатора спирт легко дегидратируется, т. е. отщепляет воду (приставка «де» указывает на отделение чего-либо):

Эта реакция используется для получения этилена в лаборатории. При более слабом нагревании спирта с серной кислотой (не выше 140°) каждая молекула воды отщепляется от двух молекул спирта, вследствие чего образуется диэтиловый эфир - летучая легко воспламеняющаяся жидкость:
Диэтиловый эфир (иногда называемый серным эфиром) применяется в качестве растворителя (чистка тканей) и в медицине для наркоза. Он относится к классу простых эфиров - органических веществ, молекулы которых состоят из двух углеводородных радикалов, соединённых посредством атома кислорода: R - О - R1
Применение этилового спирта . Этиловый спирт имеет большое практическое значение. Много этилового спирта расходуется на получение синтетического каучука по способу академика С. В. Лебедева. Пропуская пары этилового спирта через специальный катализатор, получают дивинил:
который затем может полимеризоваться в каучук.
Спирт идёт на выработку красителей, диэтилового эфира, различных «фруктовых эссенций» и ряда других органических веществ. Спирт как растворитель применяется для изготовления парфюмерных продуктов, многих лекарств. Растворяя в спирте смолы, готовят различные лаки. Высокая теплотворная способность спирта обусловливает применение его в качестве горючего (автомобильного топлива = этанола).
Получение этилового спирта . Мировое производство спирта измеряется миллионами тонн в год.
Распространённым способом получения спирта является брожение сахаристых веществ в присутствии дрожжей. В этих низших растительных организмах (грибках) вырабатываются особые вещества - ферменты, которые служат биологическими катализаторами реакции брожения.
В качестве исходных материалов в производстве спирта берут семена злаков или клубни картофеля, богатые крахмалом. Крахмал с помощью солода, содержащего фермент диастаз, сперва превращают в сахар, который затем сбраживают в спирт.
Учёные много работали над тем, чтобы заменить пищевое сырьё для получения спирта более дешёвым непищевым сырьём. Эти поиски увенчались успехом.
В последнее время в связи с тем, что при крекинге нефти образуется много этилена, стали
Реакция гидратации этилена (в присутствии серной кислоты) была изучена ещё А. М. Бутлеровым и В. Горяиновым (1873), который предсказал и её промышленное значение. Разработан и внедрен в промышленность также метод прямой гидратации этилена пропусканием его в смеси с парами воды над твердыми катализаторами. Получение спирта из этилена очень экономично, так как этилен входит в состав газов крекинга нефти и других промышленных газов и, следовательно, является широкодоступным сырьем.
Другой способ основан на использовании в качестве исходного продукта ацетилена. Ацетилен подвергается гидратации по реакции Кучерова, а образующийся уксусный альдегид каталитически восстанавливают водородом в присутствии никеля в этиловый спирт. Весь процесс гидратации ацетилена с последующим восстановлением водородом на никелевом катализаторе в этиловый спирт может быть представлен схемой.
Гомологический ряд спиртов
Кроме этилового спирта, известны и другие спирты, сходные с ним по строению и свойствам. Все они могут рассматриваться как производные соответствующих предельных углеводородов, в молекулах которых один атом водорода заменён гидроксильной группой:
Таблица
|
Углеводороды |
Спирты |
Температура кипения спиртов в º С |
| Метан СН 4 | Метиловый СН 3 ОН | 64,7 |
| Этан С 2 Н 6 | Этиловый С 2 Н 5 ОН илиСН 3 - СН 2 - ОН | 78,3 |
| Пропан С 3 Н 8 | Пропиловый С 4 Н 7 ОН или СН 3 - СН 2 - СН 2 - ОН | 97,8 |
| Бутан С 4 Н 10 | Бутиловый С 4 Н 9 ОН илиСН 3 - СН 2 - СН 2 - ОН | 117 |
Будучи сходны по химическим свойствам и отличаясь друг от друга по составу молекул на группу атомов СН 2 , эти спирты составляют гомологический ряд. Сравнивая физические свойства спиртов, мы в этом ряду, так же как и в ряду углеводородов, наблюдаем переход количественных изменений в изменения качественные. Общая формула спиртов данного ряда R - ОН (где R - углеводородный радикал).
Известны спирты, в молекулы которых входит несколько гидроксильных групп, например:

Группы атомов, обусловливающие характерные химические свойства соединений, т. е. их химическую функцию, называются функциональными группами.
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединённых с углеводородным радикалом .
По своему составу спирты отличаются от углеводородов, соответствующих им по числу углеродных атомов, наличием кислорода (например, С 2 Н 6 и С 2 Н 6 О или С 2 Н 5 ОН). Поэтому спирты можно рассматривать как продукты частичного окисления углеводородов.
Генетическая связь между углеводородами и спиртами
Произвести непосредственное окисление углеводорода в спирт довольно трудно. Практически проще это сделать через галогенопроизводное углеводорода. Например, чтобы получить этиловый спирт, исходя из этана С 2 Н 6 , можно сначала получить бромистый этил по реакции:
а затем бромистый этил превратить в спирт нагреванием с водой в присутствии щёлочи:
Щёлочь при этом нужна, чтобы нейтрализовать образующийся бромистый водород и устранить возможность реакции его со спиртом, т.е. сдвинуть эту обратимую реакцию вправо.
Подобным же образом метиловый спирт может быть получен по схеме:
Таким образом, углеводороды, их галогенопроизводные и спирты находятся между собой в генетической связи (связи по происхождению).
В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы.
Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала.
Примеры спиртов:
Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами .
Примеры фенолов:
Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы

очень похожи и создают впечатление веществ одного класса органических соединений.
Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства.
Химические свойства спиртов
Одноатомные спирты
Реакции замещения
Замещение атома водорода в гидроксильной группе
1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al 2 O 3), при этом образуются алкоголяты металлов и выделяется водород:
Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются:
CH 3 OK + Н 2 О = СН 3 ОН + KOH
2) Реакция этерификации
Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров.
Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента:
Замещение гидроксильной группы
1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода:
2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al 2 O 3) могут быть получены первичные, вторичные или третичные амины:
Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака.
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH 3 -O-CH 3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
2СН 3 -ОН + 3O 2 = 2CO 2 + 4H 2 O + Q
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al 2 O 3 ); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Бо льшая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Химические свойства фенолов
Как уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца.
Реакции с участием гидроксильной группы
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы:
Бо льшая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами:
Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту:
Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов:
3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами:
Реакции замещения в ароматическом ядре
Гидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара- положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом.
Галогенирование
Реакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола:
Нитрование
При действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета:
Реакции присоединения
Поскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов.
Спирты – разнообразный и обширный класс химических соединений.
Спирты – это химические соединения, молекулы которых содержатся гидроксильные группы ОН, соединённые с углеводородным радикалом.
Углеводородный радикал состоит из атомов углерода и водорода. Примеры углеводородных радикалов - СН 3 - метил, С 2 Н 5 – этил. Часто углеводородный радикал обозначают просто буквой R. Но если в формуле присутствуют разные радикалы, их обозначают R", R ", R """ и т.д.
Названия спиртов образуются путём добавления суффикса –ол к названию соответствующего углеводорода.
Классификация спиртов

Спирты бывают одноатомные и многоатомные. Если в молекуле спирта только одна гидроксильная группа, то такой спирт называется одноатомным. Если же количество гидроксильных групп 2, 3, 4 и т.д., то это многоатомный спирт.
Примеры одноатомных спиртов: СН 3 -ОН – метанол или метиловый спирт, СН 3 СН 2 -ОН – этанол или этиловый спирт.
Соответственно, в молекуле двухатомного спирта присутствуют две гидроксильные группы, в молекуле трёхатомного – три и т.д.
Одноатомные спирты
Общую формулу одноатомных спиртов можно представить как R-OH.
По типу свободного радикала, входящего в молекулу, одноатомные спирты делятся на предельные (насыщенные), непредельные (ненасыщенные) и ароматические спирты.
В насыщенных углеводородных радикалах атомы углерода соединены простыми связями С – С. В ненасыщенных радикалах присутствуют одна или несколько пар атомов углерода, соединённых двойными С = С или тройными С ≡ С связями.
В состав предельных спиртов входят предельные радикалы.
CH 3 CH 2 CH 2 -OH – предельный спирт пропанол-1 или пропиленовый спирт.
Соответственно, непредельные спирты содержат непредельные радикалы.
CH 2 = CH - CH 2 - OH – непредельный спирт пропенол 2-1 (аллиловый спирт)
А в молекулу ароматических спиртов входит бензольное кольцо C 6 H 5.
C 6 H 5 -CH 2 -OH – ароматический спирт фенилметанол (бензиловый спирт).
В зависимости от типа атома углерода, связанного с гидроксильной группой, спирты делятся на первичные ((R-CH 2 -OH), вторичные (R-CHOH-R") и третичные (RR"R""C-OH) спирты.
Химические свойства одноатомных спиртов

1. Спирты горят, образуя углекислый газ и воду. При горении выделяется тепло.
C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O
2. При реакции спиртов со щелочными металлами образуется алкоголят натрия и выделяется водород.
C 2 H 5 -OH + 2Na → 2C 2 H 5 ONa + H 2
3. Реакция с галогеноводородом. В результате реакции образуется галогеноалкан (бромэтан и вода).
C 2 H 5 OH + HBr → C 2 H 5 Br + H 2 O
4. Внутримолекулярная дегидратация происходит при нагревании и под воздействием концентрированной серной кислоты. В результате получается непредельный углеводород и вода.
Н 3 – СН 2 – ОН → СН 2 = СН 2 + Н 2 О
5. Окисление спиртов. При обычной температуре спирты не окисляются. Но при помощи катализаторов и при нагревании окисление происходит.
Многоатомные спирты
Как вещества, содержащие гидроксильные группы, многоатомные спирты имеют химические свойства, схожие со свойствами одноатомных спиртов, но реакция у них идёт сразу по нескольким гидроксильным группам.
Многоатомные спирты вступают в реакцию с активными металлами, с галогеноводородными кислотами, с азотной кислотой.
Получение спиртов

Рассмотрим способы получения спиртов на примере этанола, формула которого С 2 Н 5 ОН.
Наиболее старый из них – отгонка спирта из вина, где он образуется в результате брожения сахаристых веществ. Сырьём для получения этилового спирта служат также крахмалосодержащие продукты, которые с помощью процесса брожения превращают в сахар, который затем сбраживают в спирт. Но производство этилового спирта таким способом требует большого расхода пищевого сырья.
Гораздо совершеннее синтетический способ получения этилового спирта. В этом случае проводят гидратацию этилена водяным паром.
С 2 Н 4 + Н 2 О → С 2 Н 5 ОН
Среди многоатомных спиртов наиболее известен глицерин, который получают расщеплением жиров или синтетическим способом из пропилена, который образуется при высокотемпературной переработке нефти.
Цели:
- Обучающие: ознакомить обучающихся с классификацией спиртов, их номенклатурой и изомерией. Рассмотреть влияние строения спиртов на их свойства. Развивающие: Закрепить навыки работы в группах, развивать умения для поиска взаимосвязи между новым и изученным материалом. Воспитательные: формирование навыков работы в коллективе Ученик – ученик, Ученик – учитель. Уметь анализировать полученную информацию.
Тип урока: Комбинированный
Организационная форма: фронтальный опрос, лабораторная работа, самостоятельная работа, беседа по проблемным вопросам, анализ полученной информации.
Оборудование :
1. Комплект слайдов (Приложение 1
) таблицы, индивидуальные листы с заданием для самостоятельной работы, задание для лабораторной работы.
2. На ученических столах: склянки со спиртами (этиловым, изопропиловым, глицерином), натрий, оксид меди(2), уксусная кислота, фенолфталеин, перманганат калия, песок, гидроксид натрия, соляная кислота, водопроводная вода, химическая посуда, правила по ТБ.
План урока:
1. 1.Определение класса спиртов, строение молекулы одноатомных предельных спиртов.
2. Классификация спиртов по трем признакам.
3. Номенклатура спиртов.
4. Виды изомерии одноатомных предельных спиртов.
5. Физические свойства спиртов. Влияние водородной связи на физические свойства спиртов.
2. 6.Химические свойства.
7. Закрепление нового материала.
ХОД УРОКА
I. Организационный момент
Учитель: Мы закончили изучение большого класса органических соединений, состоящих только из двух химических элементов – углерода и водорода. Какие еще химические элементы наиболее часто входят в состав органических соединений?
Ученик: Кислород, азот , фосфор, сера и другие.
II. Изучение нового материала
Учитель:
Мы начинаем изучение нового класса органических соединений, в состав которых, помимо углерода и водорода, входит кислород. Они называются кислородосодержащими. (Слайд №1).
Как видим органических соединений состоящих из углерода, водорода и кислорода несколько классов. Сегодня мы начинаем изучение класса который называется «Спирты». Молекулы спиртов содержат гидроксильную группу, которая является функциональной группой (ФГ) для этого класса. Что мы называем ФГ? (Слайд №1).
Ученик: Группа атомов (или атом) определяющих принадлежность соединения к определенному классу и обусловливающая его важнейшие химические свойства называется ФГ.
Учитель:
Спирты большой по разнообразию и свойствам класс органических соединений которые широко применяются в различных областях народного хозяйства. (Слайды №2-8)
Как видим это фармацевтика, производство косметики, пищевая промышленность , а также как расстворитель, при производстве пластмасс, лаков, красок и др. Рассмотрим таблицу.
Таблица 1.
НЕКОТОРЫЕ ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ КЛАССА СПИРТОВ
Учитель
: Если говорить о действии на организм человека, то все спирты – яды. Молекулы спирта пагубно действуют на живые клетки. (Слайд№9) Спиты - алканы имеют устаревшее название алкоголи. Спирты это производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильные группы – ОН.
В самом простом случае строение спирта можно выразить следующей формулой:
R – OH ,
где R – углеводородный радикал.
Спирты можно классифицировать по трем признакам:
1. Числу гидроксильных групп (одноатомные, двухатомные, многоатомные).
Таблица 2.
КЛАССИФИКАЦИЯ СПИРТОВ ПО ЧИСЛУ ГИДРОКСИЛЬНЫХ ГРУПП (–ОН)

2. Характеру УВ радикала (предельные, непредельные, ароматические).
Таблица 3.
КЛАССИФИКАЦИЯ СПИРТОВ ПО ХАРАКТЕРУ РАДИКАЛА

3. Характеру атома углерода, с которым связана гидроксильная группа (первичные, вторичные, третичные)
Таблица 4.
КЛАССИФИКАЦИЯ СПИРТОВ ПО ХАРАКТЕРУ АТОМА УГЛЕРОДА СВЯЗАННОГО С ФУНКЦИОНАЛЬНОЙ ГРУППОЙ –ОН

Четвертичных спиртов не существует, т. к. четвертичный атом С связан с 4 другими атомами С, поэтому на связь с гидроксильной группой нет больше валентностей.
Рассмотрим основные принципы построения названий спиртов соответственно заместительной номенклатуре, используя схему:
Название спирта = название УВ + (префикс) + - ОЛ +
(n1, n2 ..., nn), где префикс
обозначает число групп –ОН в молекуле: 2 – «ди», 3 – «три», 4 – «тетра» и т. д.
n
указывает положение гидроксильных групп в углеродной цепи, например:

Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий УВ гептан.
3. Число групп –ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название спирта гептандиол-2,4

Мы с вами в школьном курсе будем подробно изучать одноатомные предельные спирты с общей формулой: CnH2n+1OH
Рассмотрим модели молекул отдельных представителей этих спиртов (метилового, этилового, глицерина). (Слайды № 10-13)
Гомологический ряд этих спиртов начинается с метилового спирта:
CH3 – OH – метиловый спирт
CH3 – CH2 – OH – этиловый спирт
CH3 – CH2 – CH2 – OH – пропиловый спирт
CH3 – CH2 – CH2 – CH2 – OH – бутиловый спирт
CH3 – CH2 – CH2 – CH2 – CH2 – OH – амиловый
спирт или пентанол
Изомерия
Для предельных одноатомных спиртов характерны следующие виды изомерии :
1) положения функциональных групп

2) углеродного скелета.

Заметьте – нумерация атомов углерода начинается с конца, близкого к группе –ОН.
3) межклассовая изомерия (с простыми эфирами R – O – R)

Физические свойства спиртов
Первые десять членов гомологического ряда представителей одноатомных спиртов являются жидкостями, высшие спирты твердые вещества. (Слайды 14, 15)
Сильное влияние на физические свойства спиртов оказывает водородная связь образующаяся между молекулами спиртов. Вы знакомы с водородной связью по программе 9 класса , тема «Аммиак». Сейчас ваш одноклассник, получивший на прошлом уроке индивидуальное задание, напомнит нам что такое водородная связь.
Ответ ученика
Водородная связи это связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов другой молекулы. (F, O,N, CL). На письме обозначается тремя точками. (Слайды 16,17). Водородная связь это особый вид межмолекулярной связи, которая слабее обычной ковалентной связи в 10-20 раз, но она оказывает большое влияние на физические свойства соединений.
Два следствия водородной связи: 1) хорошая растворимость веществ в воде; 2) повышение температуры плавления и кипения. Например: зависимость температуры кипения некоторых соединений от наличия водородной связи.

Учитель: Какие выводы можем сделать о влиянии водородной связи на физические свойства спиртов?
Ученики:
1) При наличии водородной связи сильно возрастает температура кипения.
2) Чем больше атомность спирта, тем больше водородных связей образуется.
Это также способствует увеличению температуры кипения.
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ
(Повторить ПТБ)
Горение спиртов.
2.Взаимодействие спиртов со щелочными металлами.
3. Окисление спиртов (качественная реакция) - получение альдегидов.
4. .Взаимодействие спиртов с кислотами с образованием сложных эфиров (реакция этерификации).
5. Внутримолекулярная дегидратация спиртов с образованием непредельных углеводородов.
6. Межмолекулярная дегидратация спиртов с образованием простых эфиров.
7. Дегидрирование спиртов – получение альдегидов.
Учитель: составить стих из пяти строчек (Синквейн)
1-я ключевое слово
2-я два прилагательных
3-я три глагола
4-я предложение
5-я слово ассоциирующее с ключевым словом.
Ученик. Спирты.
Ядовитые, жидкие
Поражают, разрушают, губят
Оказывают наркотическое воздействие на организм человека.
Наркотики.
IV. Домашнее задание: параграф № 9,стр.66-70 упр. № 13 б.
Индивидуальные задания. Используя дополнительную литературу: 1) рассказать о сферах применения глицерина и этиленгликоля; 2) рассказать о получении спиртов из целлюлозы и жиров; 3) как действуют эти спирты на организм человека?
V. Итог урока подведем в виде выполнения самостоятельной работы в двух варианта
Литература:
1. Химия 10 класс. Учебник для общеобразовательных учебных заведений. Дрофа Москва 2008 год. Базовый уровень.4-е изд. стереотипное.
2. Химия 100 класс рабочая тетрадь к учебнику. Базовый уровень. Дрофа, 2007 год.
3. Поурочные разработки по химии. К учебникам О. С Габриеляна, . 10 класс
4. , . Химия 9 класс Смоленск Ассоциация XXIвек 2006
5. . ХИМИЯ. Новое уч. пособие для поступающих в вузы. Изд. 4-е, исправленное и дополненное. Ростов-на-Дону. Феникс 2007.
1. Классификация гидроксилпроизводных углеводородов.
2. Предельные одноатомные спирты (алканолы).
3. Многоатомные спирты.
4. Фенолы.
5. Простые эфиры.
Гидроксилпроизводными углеводородов называются соединения, которые образуются в результате замещения в молекуле углеводорода одного или нескольких атомов водорода на гидроксильные группы.
Гидроксилпроизводные углеводородов со связью С(sр 3)-ОН называются спиртами. Это предельные алифатические и циклические спирты, например СН 3 ОН и,
непредельные спирты, например СН 2 =СН-СН 2 -ОН, ароматические спирты -
Гидроксилпроизводные, содержащие связь С(sр 2)-ОН, называются енолами R-СН=СН-ОН и фенолами
По числу гидроксильных групп, содержащихся в молекуле, спирты и фенолы могут быть одно (одна ОН-группа)-, двух (две ОН-группы)-, трех- и многоатомными.
Нахождение в природе. В отличие от галогенопроизводных углеводородов спирты и фенолы, их производные широко представлены в растительном и животном мире.
Высшие спирты встречаются в свободном виде (например, цетиловый спирт С 16 Н 33 ОН), в составе сложных эфиров с высшими жирными кислотами (спермацет, воски). Непредельные спирты являются составной частью эфирных масел. Природными циклическими спиртами являются ментол и холестерин. Глицерин входит в состав природных растительных и животных жиров и масел.
Фенолы и их простые эфиры входят в состав эфирных масел многих душистых растений, например чабреца, тимьяна, тмина, аниса, эстрагона, укропа и т.д. Многоатомные фенолы и их производные - душистые вещества растений (например гвоздики, мускатного ореха), составная часть гликозидов растений, дубильных веществ чая, кофе и т.д.
1. Предельные одноатомные спирты (алканолы).
Общая формула С n Н 2 n +1 ОН.
Номенклатура. По заместительной номенклатуре гидроксильная группа в названии спиртов обозначается суффиксом -ол. По радикально-функциональной номенклатуре в названии указывают радикал и добавляют -овый спирт: С 2 Н 5 ОН - этанол или этил овый спирт,
СН 3 -СН 2 -СН 2 -ОН - пропанол-1 или пропил овый спирт.
Получение:
а) гидролиз галогеналканов. Галогеналканы в реакциях с водой или водным раствором щелочи легко образуют спирты (см. «Галогенпроизводные углеводородов»):
С 2 Н 5 Вr + NаОН(водный раствор) → С 2 Н 5 ОН + NаВr.
б) гидратация алкенов. Присоединение воды к алкенам происходит в присутствии катализатора (см. «Алкены»):
СН 2 =СН 2 + Н-ОН СН 3 -СН 2 -ОН.
в) гидрирование карбонильных соединений.
Каталитическое гидрирование альдегидов и кетонов приводит к образованию спиртов (см. «Альдегиды и кетоны»):
СН 3 -СН=О + Н 2 → СН 3 -СН 2 -ОН

Катализаторы: Ni, Pt, Pd.
г) реакции магнийорганических соединений. Легко происходит присоединение магнийорганических соединений к альдегидам и кетонам (см.«Альдегиды и кетоны»):
Из метаналя образуется первичный спирт, из альдегидов - вторичные спирты, кетонов - третичные спирты.
Особенность реакций этого типа - продукты реакции - спирты содержат больше атомов углерода по сравнению с исходными карбонильными соединениями.
д) гидрирование оксида углерода (II). В зависимости от природы катализатора и условий реакции получают метанол или смесь различных спиртов (синтол): СО + 2Н 2 → СН 3 -ОН.
Катализаторы: ZnO, Co и другие.
е) спиртовое брожение углеводов. Глюкоза в присутствии дрожжей подвергается брожению с образованием этилового спирта и углекислого газа: С 6 Н 12 О 6 → 2СН 3 -СН 2 -ОН + 2СО 2
Изомерия. Для предельных спиртов характерна структурная изомерия: изомерия углеродной цепи, расположения гидроксильной группы в цепи. По положению гидроксильной группы в цепи различают первичные (R-СН 2 -ОН), вторичные (R 2 СН-ОН) и третичные (R 3 С-ОН) спирты.
Для спиртов характерна межклассовая изомерия (метамерия), спиртам изомерны простые эфиры с общей формулой R-O-R.
СН 3 -СН 2 -СН ОН-СН 3 (см. «Оптическая изомерия»).
Строение. В спиртах атомы углерода и кислорода находятся вsр 3 - гибридизации. Спирты содержат две полярные σ-связи: С-О (sр 3 -sр 3 -перекрывание) и О-Н (sр 3 -s -перекрывание). Диполи этих связей направлены в сторону атома кислорода, причем дипольный момент связи О-Н выше, чем связи С-О. Алканолы являются полярными соединениями:
Ассоциация молекул спиртов осуществляется за счет образования межмолекулярных водородных связей:

в результате спирты, по сравнению с углеводородами и галогенпроизводными углеводородов, имеют более высокие температуры кипения и плавления. Образование водородных связей между молекулами спиртов и воды способствует растворению этих соединений в воде.
Химические свойства.
Химические свойства спиртов обусловлены наличием в молекуле полярных связей С-О и О-Н и неподеленных электронных пар на атоме кислорода.
а) кислотные свойства
Спирты являются слабыми О-Н-кислотами. Ряд кислотности: RСООН > НОН > RОН.
В водном растворе кислотность самих спиртов уменьшается в следующем направлении: метанол > первичные > вторичные > третичные.
Кислотные свойства спиртов проявляются в образовании солей (алкоголятов или алкоксидов) при взаимодействии с металлами:
2С 2 Н 5 ОН + 2Nа → 2 С 2 Н 5 О - Nа + + Н 2
этанол этилат(этоксид) натрия
В водных растворах соли гидролизуются с образованием спиртов и щелочей:
С 2 Н 5 О - Nа + + НОН → С 2 Н 5 ОН + NаОН
б) основные и нуклеофильные свойства
Основные и нуклеофильные свойства спиртов обусловлены неподеленной электронной парой на атоме кислорода.
Основные свойства увеличиваются в следующем направлении
метанол < первичные < вторичные < третичные спирты и проявляются в образовании оксониевых солей: С 2 Н 5 ОН + Н + → С 2 Н 5 ОН 2 + . Образование оксониевых солей играет важную роль в реакциях нуклеофильного замещения и отщепления.
Таким образом, спирты являются амфотерными соединениями.
Слабые нуклеофильные свойства спиртов и алкоголятов проявляются в реакциях
Алкилирования - взаимодействия со спиртами и алкоголятами с образованием простых эфиров (реакция Вильямсона, протекает при нагревании): СН 3 B r + С 2 Н 5 О Nа → С 2 Н 5 ОСН 3 + NаBr
метилбромид этилат натрия метоксиэтан,
Ацилирования - взаимодействия с карбоновыми кислотами и их производными с образование сложных эфиров (реакция этерификации, протекает в присутствии катализатора):
СН 3 СООН + С 2 Н 5 О Н ↔ СН 3 СООС 2 Н 5 + НОН
уксусная кислота этанол этилацетат,
С карбонильными соединениями - образование полуацеталей и ацеталей:
этаналь метанол 1-метоксиэтанол 1,2-диметоксиэтанол.
Алкоголяты по сравнению со спиртами являются более сильными основаниями и нуклеофилами.
в) реакции замещения гидроксильной группы (нуклеофильное замещение - S N )
Часто в этих реакциях ОН-группу модифицируют с помощью минеральных кислот или кислот Льюиса (образование оксониевых солей RОН 2 +). Модифицированная гидроксильная группа легко замещается на атом галогена, амино- и алкоксигруппу и другие группы. Реакционная активность спиртов в этих реакциях увеличивается в следующем направлении: первичные < вторичные < третичные.
Примеры реакций. Замещение гидроксильной группы на атом галогена:
R-ОН + SOCl 2 → R-Cl + НCl + SО 2
R-ОН + РН al 5 → R-Нal + Н-Нal + РОНal 3
R-ОН + Н-Н al → R-Нal + НОН
Реакционная активность галогеноводородов увеличивается в направлении НСl < НBr <НJ. Однако иодоводород практически не используют в реакциях этого типа, поскольку он легко восстанавливает спирты до углеводородов.
Замещение гидроксильной группы на амино- и алкоксигруппу:
R-ОН + Н- N Н 2 →R- NН 2 + НОН
R-ОН + RО- Н→ R-О-R + НОН.
Взаимодействие с минеральными кислотами с образованием сложных эфиров:
R-ОН + Н-О N О 2 →R-ОNО 2 + НОН
алкилнитрат
R-ОН + Н-О S О 3 →R-ОSО 3 + НОН
алкилсульфат
Реакции нуклеофильного замещения протекают по мономолекулярному (S N 1) или бимолекулярному (S N 2) механизму.
г) реакции отщепления гидроксильной группы (Е-типа, дегидратация спиртов)
Отщепление воды происходит при нагревании в присутствии катализатора - серной или фосфорной кислот, оксида цинка или алюминия. Дегидратация спиртов с образованием алкенов протекает в соответствии с правилом Зайцева: гидроксильная группа отщепляется от α-углеродного атома, водород - от менее гидрированного β-атома углерода спирта:
1-бутанол 2-бутен
Реакционная активность спиртов увеличивается в следующем направлении: первичные < вторичные < третичные.
Реакции отщепления протекают по мономолекулярному (Е1) или бимолекулярному (Е2) механизму.
д) окисление спиртов
В реакциях окисления более активны первичные спирты, третичные спирты в аналогичных условиях не окисляются. Окислители: перманганат калия или бихромат калия в кислой среде. Первичные спирты окисляются с образованием альдегидов и далее - карбоновых кислот, вторичные спирты - кетонов:
R-ОН + [ О ] → R-СН=О → R-СООН
R 2 СН-ОН + [ О ] → R 2 С=О
Первичные и вторичные спирты могут быть превращены в карбонильные соединения при дегидрировании. Реакции протекают при 400-500 0 С в присутствии катализатора - Cu/Аg: