Гелій - другий порядковий елемент періодичної системи хімічних елементів Д. І. Менделєєва, з атомним номером 2. Розташований у головній підгрупі восьмої групи, першому періоді періодичної системи. Очолює групу інертних газів у періодичній таблиці. Позначається символом He (лат. Helium). Проста речовина гелій (CAS-номер: 7440-59-7) - інертний одноатомний газ без кольору, смаку та запаху. Гелій - один із найпоширеніших елементів у Всесвіті, він займає друге місце після водню. Також гелій є другим за легкістю (після водню) хімічним елементом. Гелій видобувається з природного газу процесом низькотемпературного поділу - так званою фракційною перегонкою
18 серпня 1868 року французький вчений П'єр Жансен, перебуваючи під час повного сонячного затемнення в індійському місті Гунтур, вперше досліджував хромосферу Сонця. Жансен вдалося налаштувати спектроскоп таким чином, щоб спектр корони Сонця можна було спостерігати не тільки при затемненні, але і в звичайні дні. Наступного дня спектроскопія сонячних протуберанців поруч із лініями водню - синій, зелено-блакитний і червоною - виявила дуже яскраву жовту лінію, спочатку прийняту Жансеном та інші астрономами, що спостерігали її за лінію D натрію. Жансен негайно написав про це у Французьку Академію наук. Згодом було встановлено, що яскраво-жовта лінія в сонячному спектрі не збігається з лінією натрію і не належить до жодного з раніше відомих хімічних елементів.
Через два місяці 20 жовтня англійський астроном Норман Лок'єр, не знаючи про розробки французького колеги, також провів дослідження сонячного спектру. Виявивши невідому жовту лінію з довжиною хвилі 588 нм (точніше 587,56 нм), він позначив її D3, оскільки вона була дуже близько розташована до Фраунгоферових ліній D 1 (589,59 нм) і D 2 (588,99 нм) натрію. Через два роки Лок'єр, спільно з англійським хіміком Едвардом Франкландом, у співпраці з яким він працював, запропонував дати новому елементу назву «гелій» (від грец. ἥλιος - «сонце»).
Цікаво, що листи Жансена і Лок'єра прийшли до Французької Академії наук одного дня - 24 жовтня 1868 року, проте лист Лок'єра, написаний ним чотирма днями раніше, надійшов кілька годин раніше. Наступного дня обидва листи були зачитані на засіданні Академії. На честь нового методу дослідження протуберанців Французька академія вирішила викарбувати медаль. На одному боці медалі були вибиті портрети Жансена і Лок'єра над схрещеними гілками лавра, а на іншій - зображення міфічного бога Сонця Аполлона, що править у колісниці четвіркою коней, що стрибає на весь опор.
У 1881 році італієць Луїджі Пальмієрі опублікував повідомлення про відкриття гелію в вулканічних газах (фумаролах). Він досліджував світло-жовту маслянисту речовину, що осідала з газових струменів на краях кратера Везувію. Пальмієрі проколював цей вулканічний продукт у полум'ї бунзенівського пальника і спостерігав спектр газів, що виділялися при цьому. Вчені кола зустріли це повідомлення з недовірою, оскільки свій досвід Пальмієрі описав неясно. Через багато років у складі фумарол дійсно було знайдено невелику кількість гелію та аргону.
Тільки через 27 років після свого первісного відкриття гелій був виявлений на Землі - в 1895 році шотландський хімік Вільям Рамзай, досліджуючи зразок газу, отриманого при розкладанні мінералу клевеїта, виявив у його спектрі ту ж яскраво-жовту лінію, знайдену раніше в сонячному. Зразок був направлений для додаткового дослідження відомому англійському вченому-спектроскопісту Вільяму Круксу, який підтвердив, що жовта лінія, що спостерігається в спектрі зразка, збігається з лінією D3 гелію. 23 березня 1895 року Рамзай відправив повідомлення про відкриття ним гелію на Землі до Лондонського королівського товариства, а також до Французької академії через відомого хіміка Марселена Бертло.
В 1896 Генріх Кайзер, Зігберт Фрідлендер, а ще через два роки Едвард Белі остаточно довели присутність гелію в атмосфері.
Ще до Рамзаю гелій виділив також американський хімік Френсіс Хіллебранд, проте він помилково вважав, що отримав азот і в листі до Рамзая визнав за ним пріоритет відкриття.
Досліджуючи різні речовини та мінерали, Рамзай виявив, що гелій у них супроводжує урану та торію. Але значно пізніше, в 1906 році, Резерфорд і Ройдс встановили, що альфа-частинки радіоактивних елементів являють собою ядра гелію. Ці дослідження започаткували сучасну теорію будови атома.
Тільки в 1908 році нідерландському фізику Хейке Камерлінг-Оннесу вдалося отримати рідкий гелій дроселюванням (див. Ефект Джоуля - Томсона), після того як газ був попередньо охолоджений в рідкому водні, що кипів під вакуумом. Спроби отримати твердий гелій ще довго залишалися безуспішними навіть за температури 0,71 K, яких досяг учень Камерлінг-Оннеса - німецький фізик Віллем Хендрік Кеезом. Лише в 1926 році, застосувавши тиск вище 35 атм і охолодивши стислий гелій в киплячому під розрідженням рідкому гелії, йому вдалося виділити кристали.
У 1932 Кеезом досліджував характер зміни теплоємності рідкого гелію з температурою. Він виявив, що близько 2,19 K повільний і плавний підйом теплоємності змінюється різким падінням і крива теплоємності набуває форми грецької букви (лямбда). Звідси температурі, коли відбувається стрибок теплоємності, присвоєно умовне назва «λ-точка». Більш точне значення температури в цій точці, встановлене пізніше - 2,172 K. У λ-точці відбуваються глибокі та стрибкоподібні зміни фундаментальних властивостей рідкого гелію - одна фаза рідкого гелію змінюється в цій точці на іншу, причому без виділення прихованої теплоти; має місце фазовий перехід ІІ роду. Вище температури λ-точки існує так званий гелій-I, а нижче за неї - гелій-II.
У 1938 році радянський фізик Петро Леонідович Капіца відкрив явище надплинності рідкого гелію-II, яке полягає в різкому зниженні коефіцієнта в'язкості, внаслідок чого гелій тече практично без тертя. Ось що він писав у одному зі своїх доповідей про відкриття цього явища.
походження назви
Від грец. ἥλιος - "Сонце" (див. Геліос). Цікавий той факт, що в назві елемента було використано характерне для металів закінчення "-ий" (по лат. "-um" - "Helium"), оскільки Лок'єр припускав, що відкритий ним елемент є металом. За аналогією з іншими благородними газами, логічно було б дати йому ім'я «геліон» («Helion»). У сучасній науці назва «геліон» закріпилася за ядром легкого ізотопу гелію – гелію-3.
Поширеність
У Всесвіті
Гелій посідає друге місце за поширеністю у Всесвіті після водню - близько 23% за масою. Однак на Землі гелій рідкісний. Практично весь гелій Всесвіту утворився в перші кілька хвилин після Великого Вибуху під час первинного нуклеосинтезу. У сучасному Всесвіті майже весь новий гелій утворюється в результаті термоядерного синтезу з водню в надрах зірок (див. протон-протонний цикл, вуглецевий-азотний цикл). На Землі він утворюється в результаті альфа-розпаду важких елементів (альфа-частинки, що випромінюються при альфа-розпаді - це ядра гелію-4). Частина гелію, що виник при альфа-розпаді і просочується крізь породи земної кори, захоплюється природним газом, концентрація гелію в якому може досягати 7% від об'єму і вище.
Земна кора
У рамках восьмої групи гелій за вмістом у земній корі посідає друге місце (після аргону). Зміст гелію в атмосфері (утворюється в результаті розпаду Ac, Th, U) - 5,27 10-4 % за обсягом, 7,24 10-5 % за масою. Запаси гелію в атмосфері, літосфері та гідросфері оцінюються в 5×10 14 м³. Геліоносні природні гази містять зазвичай до 2% гелію за обсягом. Винятково рідко трапляються скупчення газів, гелієносність яких досягає 8 - 16%. Середній вміст гелію у земній речовині - 3 г/т. Найбільша концентрація гелію спостерігається в мінералах, що містять уран, торій та самарій: кльовіїті, фергюсоніті, самарскіті, гадоліните, монациті (монацитові піски в Індії та Бразилії), торіаніті. Вміст гелію в цих мінералах становить 0,8 - 3,5 л/кг, а в торіаніті він досягає 10,5 л/кг.
Визначення
Якісно гелій визначають за допомогою аналізу спектрів випромінювання (характеристичні лінії 587,56 нм та 388,86 нм), кількісно - мас-спектрометричними та хроматографічними методами аналізу, а також методами, заснованими на вимірі фізичних властивостей (щільності, теплопровідності та ін.).
Хімічні властивості
Гелій - найменш хімічно активний елемент восьмої групи таблиці Менделєєва (інертні гази). Багато сполук гелію існують тільки в газовій фазі у вигляді так званих ексимерних молекул, у яких стійкі збуджені електронні стани та нестійкий основний стан. Гелій утворює двоатомні молекули He2+, фторид HeF, хлорид HeCl (ексимерні молекули утворюються при дії електричного розряду або ультрафіолетового випромінювання на суміш гелію з фтором або хлором). Відомо хімічне з'єднання гелію LiHe (можливо, йшлося про з'єднання LiHe 7
Отримання
У промисловості гелій отримують з природних газів, що містять гелій (в даний час експлуатуються головним чином родовища, що містять > 0,1% гелію). Від інших газів гелій відокремлюють методом глибокого охолодження, використовуючи те, що він зріджується найважче інших газів. Охолодження проводять дроселюванням у кілька стадій, очищаючи його від CO 2 і вуглеводнів. В результаті виходить суміш гелію, неону та водню. Цю суміш, т.з. сирий гелій, (He - 70-90 % об.) очищають від водню (4-5 %) за допомогою CuO при 650-800 К. Остаточне очищення досягається охолодженням суміші, що залишилася киплячим під вакуумом N2 і адсорбцією домішок на активному вугіллі в адсорберах, також охолоджуваних рідким N2. Виробляють гелій технічної чистоти (99,80% за обсягом гелій) та високої чистоти (99,985%). У Росії її газоподібний гелій отримують з природного і нафтового газів. В даний час гелій витягується на гелієвому заводі ТОВ "Газпром видобуток Оренбург" в Оренбурзі з газу з низьким вмістом гелію (до 0,055% об.), тому російський гелій має високу собівартість. Актуальною проблемою є освоєння та комплексна переробка природних газів великих родовищ Східного Сибіру з високим вмістом гелію (0,15-1 % об.), що дозволить значно знизити його собівартість. За виробництвом гелію лідирують США (140 млн. м³ на рік), потім - Алжир (16 млн. м³). Росія займає третє місце у світі – 6 млн м³ на рік. Світові запаси гелію становлять 45,6 млрд. м³.
Хімічний елемент гелій спочатку було виявлено на Сонці і лише потім – на Землі.
Ключову роль в історії відкриття гелію відіграв Норман Лок'єр, засновник одного з передових світових наукових видань - журналу Nature. У процесі підготовки до випуску журналу він познайомився з лондонським науковим істеблішментом та захопився астрономією. Це був час, коли, натхненні відкриттям Кірхгофа-Бунзена, астрономи тільки-но починали вивчати спектр світла, що випускається зірками. Лок'єру самому вдалося зробити низку важливих відкриттів — зокрема, він першим показав, що сонячні плями холодніші за решту сонячної поверхні, а також перший вказав на наявність у Сонця зовнішньої оболонки, назвавши її хромосферою. У 1868 році, досліджуючи світло, випромінюване атомами в протуберанцях - величезних викидах плазми з поверхні Сонця, - Лок'єр помітив ряд раніше невідомих спектральних ліній ( див.Спектроскопія). Спроби отримати такі ж лінії у лабораторних умовах закінчилися невдачею, з чого Лок'єр зробив висновок, що він виявив новий хімічний елемент. Лок'єр назвав його гелієм, від грецької helios- "Сонце".
Вчені дивувалися, як їм поставитися до появи гелію. Одні припускали, що при інтерпретації спектрів протуберанців була допущена помилка, проте ця точка зору отримувала все менше прихильників, оскільки дедалі більшій кількості астрономів вдавалося спостерігати лінії Лок'єра. Інші стверджували, що на Сонці є елементи, яких немає на Землі, що, як уже говорилося, суперечить головному положенню про закони природи. Треті (їх була меншість) вважали, що колись гелій буде знайдено і на Землі.
Наприкінці 1890-х років лорд Релей і сер Вільям Рамзай провели серію дослідів, які призвели до відкриття аргону. Рамзай переробив свою установку, щоб з її допомогою досліджувати гази, що виділяються мінералами, що містять уран. У спектрі цих газів Рамзай виявив невідомі лінії та надіслав зразки декільком колегам для аналізу. Отримавши зразок, Лок'єр відразу ж дізнався про лінії, які більше чверті століття тому він спостерігав у сонячному світлі. Загадка гелію було вирішено: газ, безсумнівно, перебуває в Сонці, але існує також і тут, Землі. У наш час цей газ найбільш відомий у звичайному житті як газ для надування дирижаблів і повітряних куль ( див.Закон Грема), а в науці — завдяки його застосуванню кріогеніцітехнології досягнення наднизьких температур.
Короній та небулій
Питання про те, чи є десь у Всесвіті хімічні елементи, яких немає на Землі, не втратив своєї актуальності й у XX столітті. При дослідженні зовнішньої сонячної атмосфери – сонячної корони, Що складається з гарячої сильно розрідженої плазми, - астрономи виявили спектральні лінії, які їм не вдалося ототожнити з жодним з відомих земних елементів. Вчені припустили, що ці лінії належать новому елементу, який отримав назву короній. А при вивченні спектрів деяких туманностей- Далеких скупчень газів і пилу в Галактиці - були виявлені ще одні загадкові лінії. Їх приписали іншому «новому» елементу. небулію. У 1930-і роки американський астрофізик Айра Спрейг Боуен (Ira Sprague Bowen, 1898-1973) дійшов висновку, що лінії небулі насправді належать кисню, але набули такого вигляду через екстремальні умови, що існують на Сонці та в туманностях, причому ці умови не можуть бути відтворені в земних лабораторіях. Короній виявився сильно іонізованим залізом. А ці лінії отримали назву заборонені лінії.
Джозеф Норман ЛОК'ЄР
Joseph Norman Lockyer, 1836-1920
Англійська науковець. Народився у місті Рагбі у родині військового лікаря. Лок'єр прийшов у науку незвичайним шляхом, почавши свою кар'єру чиновником у військовому міністерстві. Щоб підробити, він, скориставшись громадським інтересом до науки, почав видавати науково-популярний журнал. У 1869 році вийшов перший номер журналу Nature, і протягом 50 років Лок'єр залишався його редактором. Він брав участь у багатьох експедиціях, які спостерігали за повними сонячними затемненнями. Одна з таких експедицій і призвела до відкриття гелію. Лок'єр також відомий як засновник археоастрономії - науки, що вивчає астрономічний сенс стародавніх споруд, таких як Стоунхендж, - та автор багатьох науково-популярних книг.
Гелій, як правило, що утворюється при радіоактивному розпаді урану-238 та урану-235, був знайдений в атмосфері Сонця на 13 років раніше, ніж на Землі. Цей газ має найнижчі значення критичних величин, найнижчу температуру кипіння, найменшу теплоту випаровування і плавлення. Щодо температури плавлення гелію, то при нормальному тиску її немає взагалі. Другої такої речовини в природі не знайти...
Гелій – елемент незвичайний, і історія його дещо загадкова та незрозуміла. Його знайшли в атмосфері Сонця на 13 років раніше, ніж на Землі. Точніше кажучи, у спектрі сонячної корони було відкрито яскраво-жовту лінію D, а що за нею ховалося, стало достовірно відомо лише після того, як гелій витягли із земних мінералів, що містять радіоактивні елементи.
Як утворюється гелій
Здебільшого земний гелій утворюється при радіоактивному розпаді урану-238, урану-235, торію та нестабільних продуктів їх розпаду. Гелій у земній корі накопичується повільно. Одна тонна граніту, що містить 2 г урану та 10 г торію, за мільйон років продукує всього 0,09 мг гелію – половину кубічного сантиметра. У небагатьох багатих ураном і торієм мінералах вміст гелію досить великий - кілька кубічних сантиметрів гелію на грам.
Більшість мінералів з часом піддається процесам вивітрювання, перекристалізації тощо, і гелій з них йде. Гелієві бульбашки, що вивільнилися з кристалічних структур, частково розчиняються в підземних водах. Інша частина гелію через пори та тріщини мінералів виходить в атмосферу. Інші молекули газу потрапляють у підземні пастки, у яких накопичуються протягом десятків, сотень мільйонів років. Як пастки тут виступають пласти пухких порід, порожнечі яких заповнюють газом. Ложем для таких газових колекторів зазвичай є вода або нафта, а зверху їх перекривають газонепроникні товщі щільних порід.
Синтез гелію – початок життя
Надра та атмосфера нашої планети бідні гелієм. Але це не означає, що його мало усюди у Всесвіті. За сучасними підрахунками, 76% космічної маси посідає водень і 23% на гелій; на всі інші елементи залишається лише один відсоток. Таким чином, світову матерію можна назвати воднево-гелієвою. Ці два елементи панують у зірках, планетарних туманностях та міжзоряному газі. Реакція синтезу гелію - основа енергетичної діяльності зірок, їх свічення. Отже, синтез гелію можна вважати предком всіх реакцій у природі, першопричиною життя, світла, тепла та метеорологічних явищ на Землі.
Природні гази є єдиним джерелом сировини для промислового отримання гелію. Гелій у природних газах присутня як незначна домішка. Зміст його не перевищує тисячних, сотих, рідко - десятих часток відсотка. Велика (1,5-10%) гелієносність метано-азотних родовищ - явище вкрай рідкісне. Для відокремлення від інших газів використовують виняткову леткість гелію, пов'язану з його низькою температурою зрідження. Після того, як інші компоненти природного газу сконденсуються при глибокому охолодженні, газоподібний гелій відкачують. Потім його очищають від домішок. Чистота заводського гелію сягає 99,995%. Рідкий гелій одержують шляхом зрідження газоподібного гелію.
Властивості гелію
Газоподібний гелій– інертний газ без кольору, запаху та смаку. Рідкий гелій- Безбарвна рідина без запаху з температурою кипіння при нормальному атмосферному тиску 101,3 кПа (760 мм.рт.ст.) 4,215 К (мінус 268,9 ° С) і щільністю 124,9 кг/м 3 .
Гелій не токсичний, не горючий, не вибухонебезпечний, проте при високих концентраціях у повітрі викликає стан кисневої недостатності та задуху. Рідкий гелій – низькокипляча рідина, яка може спричинити обмороження шкіри та ураження слизової оболонки очей.
Атом гелію(він же молекула) - найміцніша з молекулярних конструкцій. Орбіти двох його електронів абсолютно однакові і проходять гранично близько від ядра. Щоб оголити ядро гелію, потрібно витратити рекордно більшу енергію (78,61 еВ). Звідси випливає феноменальна хімічна пасивність гелію.
Молекули гелію неполярні. Сили міжмолекулярної взаємодії між ними вкрай невеликі – менше, ніж у будь-якій іншій речовині. З цієї причини гелій має найнижчі значення критичних величин, найнижчу температуру кипіння, найменшу теплоту випаровування і плавлення. Щодо температури плавлення гелію, то при нормальному тиску її взагалі немає. Рідкий гелій при будь-якій близької до абсолютного нуля температурі не твердне, якщо, крім температури, на нього не діє тиск в 25 або більше атмосфер. Другої такої речовини у природі немає. Це найкращий серед газів провідник електрики та другий, після водню, провідник тепла. Його теплоємність дуже велика, а в'язкість, навпаки, мала.
Гелій, дирижаблі, водолази та ядерна енергетика.
Вперше гелій застосували у Німеччині. В 1915 вони німці стали наповнювати їм свої дирижаблі, що бомбили Лондон. Незабаром легкий, але негорючий гелій став незамінним наповнювачем повітроплавних апаратів. Занепад дирижаблебудування, що почався в середині 30-х років, спричинив деякий спад у виробництві гелію, але лише на короткий час. Цей газ дедалі більше привертав увагу хіміків, металургів і машинобудівників.
Ще одна сфера застосування гелію обумовлена тим, що багато технологічних процесів і операцій не можна вести в повітряному середовищі. Щоб уникнути взаємодії речовини (або вихідної сировини) з газами повітря, створюють спеціальні захисні середовища, і немає для цих цілей більш відповідного газу, ніж гелій.
У гелієвій захисному середовищіпроходять окремі стадії одержання ядерного пального. У контейнерах, заповнених гелієм, зберігають та транспортують тепловиділяючі елементи ядерних реакторів. За допомогою особливих шукачів течії, дія яких заснована на винятковій дифузійній здатності гелію, виявляють найменші можливості витоку в атомних реакторах та інших системах, що знаходяться під тиском або вакуумом.
У наукових дослідженнях та у техніцішироко застосовується рідкий гелій. Наднизькі температури сприяють поглибленому пізнанню речовини та її будови – за більш високих температур тонкі деталі енергетичних спектрів маскуються тепловим рухом атомів.
Вже існують надпровідні соленоїди з особливих сплавів, що створюють за температури рідкого гелію сильні магнітні поля (до 300 тисяч ерстед) при мізерних витратах енергії. При температурі рідкого гелію багато металів і сплавів стають надпровідниками. Надпровідникові реле-кріотрони все ширше використовуються в конструкціях електронно-обчислювальних машин. Вони прості, надійні, дуже компактні. Надпровідники, а з ними рідкий гелій стають необхідними для електроніки. Вони входять до конструкції детекторів інфрачервоного випромінювання, молекулярних підсилювачів (мазерів), оптичних квантових генераторів (лазерів), приладів для вимірювання надвисоких частот.
Геліокисневі сумішістали надійним засобом профілактики кесонної хвороби та дали великий виграш за часом під час підйому водолазів. Як відомо, розчинність газів у рідинах, за інших рівних даних, прямо пропорційна тиску. У водолазів, що працюють під великим тиском, в крові розчинено азоту набагато більше, ніж нормальні умови, що існують на поверхні води. При підйомі з глибини, коли тиск наближається до нормального, розчинність азоту знижується і його надлишок починає виділятися. Якщо підйом відбувається швидко, виділення надлишку розчинених газів відбувається настільки бурхливо, що кров і багаті водою тканини організму, насичені газом, спінюються від маси бульбашок азоту - подібно до шампанського при відкриванні пляшки.
Утворення бульбашок азоту в кровоносних судинах порушує роботу серця, поява в мозку порушує його функції, проте це разом веде до важких розладів життєдіяльності організму й у результаті - до смерті. Для того, щоб запобігти розвитку описаних явищ, відомих під ім'ям «кесонної хвороби», підйом водолазів, тобто перехід від підвищеного тиску до нормального, проводиться дуже повільно.
При цьому надлишок розчинених газів виділяється поступово і жодних болючих розладів не відбувається. Із застосуванням штучного повітря, в якому азот замінюється менш розчинним гелієм, можливість шкідливих розладів усувається майже повністю. Це дозволяє збільшувати глибину опускання водолазів (до 100 і більше метрів) та подовжувати час перебування під водою.
«Гелієве» повітря має щільність втричі меншу за щільність звичайного повітря. Тому дихати таким повітрям легше, ніж звичайним (зменшується робота дихальних м'язів). Ця обставина має важливе значення при захворюванні органів дихання. Тому «гелієве» повітрязастосовується також у медициніпри лікуванні астми, ядух та інших хвороб.
Ще не вічний, але вже нешкідливий
У Лос-Аламоській національній лабораторії імені Е. Фермі (штат Нью-Мексико) розроблено новий двигун, який може серйозно змінити уявлення про автомобіль як одне з головних джерел забруднення. При порівнянному з двигуном внутрішнього згоряння коефіцієнті корисної дії (30–40%) він позбавлений основних його недоліків: частин, що рухаються, потребують мастила для зменшення тертя і зносу, і шкідливих для навколишнього середовища викидів продуктів неповного згоряння палива.
По суті, йдеться про вдосконалення добре відомого двигуна зовнішнього згоряння, запропонованого шотландським священиком Р. Стірлінгом ще в 1816 р. Цей двигун не набув широкого поширення на автотранспорті через складнішу порівняно з двигуном внутрішнього згоряння конструкції, більшу матеріаломісткість і вартість. Але термоакустичний перетворювач енергії, запропонований американськими вченими, в якому робочим тілом служить стислий гелій, вигідно відрізняється від свого попередника відсутністю громіздких теплообмінників, що перешкоджали його використанню в легкових автомобілях, і в недалекому майбутньому здатний стати екологічно прийнятною альтернативою не тільки двигуна внутрішнього згоряння. перетворювача сонячної енергії, холодильника, кондиціонера. Масштаби його застосування поки що навіть важко уявити.
Гелій - справді благородний газ. Змусити його вступити в будь-які реакції поки що не вдалося. Молекула гелію одноатомна. За легкістю цей газ поступається тільки водню, повітря в 7,25 рази важче за гелій. Гелій майже нерозчинний у воді та інших рідинах. І так само в рідкому гелії помітно не розчиняється жодна речовина.
Твердий гелій не можна отримати за жодних температур, якщо не підвищувати тиск.
В історії відкриття, дослідження та застосування цього елемента зустрічаються імена багатьох великих фізиків та хіміків різних країн. Гелієм цікавилися, з гелієм працювали: Жансен (Франція), Лок'єр, Рамзай, Крукс, Резерфорд (Англія), Пальмієрі (Італія), Кеезом, Камерлінг-Оннес (Голландія), Фейнман, Онсагер (США), Капіца, Кікоін, Ландау Радянський Союз) та багато інших великих учених.
Неповторність образу атома гелію визначається поєднанням у ньому двох дивовижних природних конструкцій - абсолютних чемпіонів з компактності та міцності. У ядрі гелію, гелію-4, насичені обидві внутрішньоядерні оболонки - і протонна, і нейтронна. Електронний дублет, що обрамляє це ядро, також насичений. У цих конструкціях – ключ до розуміння властивостей гелію. Звідси походить і його феноменальна хімічна інертність і рекордно малі розміри його атома.
Величезна роль ядра атома гелію - альфа-частинки в історії становлення та розвитку ядерної фізики. Якщо пам'ятаєте, саме вивчення розсіювання альфа-часток призвело до резерфорду відкриття атомного ядра. При бомбардуванні азоту альфа-частинками було вперше здійснено взаємоперетворення елементів - те, про що століттями мріяли багато поколінь алхіміків. Щоправда, у цій реакції не ртуть перетворилася на золото, а азот на кисень, але це зробити майже так само важко. Ті ж альфа-частинки виявилися причетними до відкриття нейтрону та отримання першого штучного ізотопу. Пізніше за допомогою альфа-частинок було синтезовано кюрій, берклій, каліфорній, менделевий.
Ми перерахували ці факти лише з однією метою – показати, що елемент №2 – елемент вельми незвичайний.
Земної гелії
Гелій – елемент незвичайний, і історія його незвичайна. Він був відкритий в атмосфері Сонця на 13 років раніше, ніж Землі. Точніше кажучи, у спектрі сонячної корони було відкрито яскраво-жовту лінію D, а що за нею ховалося, стало достовірно відомо лише після того, як гелій витягли із земних мінералів, що містять радіоактивні елементи.
У земній корі налічується 29 ізотопів, при радіоактивному розпаді яких утворюються альфа-частинки - високоактивні, що мають велику енергію ядра атомів гелію.
В основному земний гелій утворюється при радіоактивному розпаді урану-238, урану-235, торію та нестабільних продуктів їх розпаду. Незрівнянно менші кількості гелію дає повільний розпад самарію-147 і вісмуту. Всі ці елементи породжують лише важкий ізотоп гелію – 4 He, чиї атоми можна розглядати як останки альфа-часток, поховані в оболонці з двох спарених електронів – в електронному дублеті. У ранні геологічні періоди, ймовірно, існували й інші, що вже зникли з Землі природно радіоактивні ряди елементів, що насичували планету гелієм. Одним із них був нині штучно відтворений нептунієвий ряд.
За кількістю гелію, замкненого в гірській породі або мінералі, можна судити про їх абсолютний вік. В основі цих вимірів лежать закони радіоактивного розпаду: так, половина урану-238 за 4,52 млрд. років перетворюється на гелійі свинець.
Гелій у земній корі накопичується повільно. Одна тонна граніту, що містить 2 г урану та 10 г торію, за мільйон років продукує всього 0,09 мг гелію - половину кубічного сантиметра. У небагатьох багатих ураном і торієм мінералах вміст гелію досить великий - кілька кубічних сантиметрів гелію на грам. Однак частка цих мінералів у природному виробництві гелію близька до нуля, оскільки вони дуже рідкісні.
Гелій пі Сонце відкрили француз Ж. Жансен, який проводив свої спостереження в Індії 10 серпня 1868 і англієць Дж. Лок'єр - 20 жовтня того ж року. Листи обох учених прийшли до Парижа одного дня і були зачитані на засіданні Паризької Академії наук 26 жовтня з інтервалом у кілька хвилин. Академіки, вражені таким дивним збігом, прийняли ухвалу вибити на честь цієї події золоту медаль.
Природні сполуки, у складі яких є альфа-активні ізотопи, - це лише першоджерело, але не сировина для промислового отримання гелію. Щоправда, деякі мінерали, що мають щільну структуру - самородні метали, магнетит, гранат, апатит, циркон та інші, - міцно утримують ув'язнений у них гелій. Однак більшість мінералів з часом піддаються процесам вивітрювання, перекристалізації тощо, і гелій з них йде.
Гелієві бульбашки, що вивільнилися з кристалічних структур, відправляються в подорож земною корою. Дуже незначна частина їх розчиняється у підземних водах. Для утворення більш менш концентрованих розчинів гелію потрібні особливі умови, насамперед великі тиску. Інша частина кочівного гелію через пори та тріщини мінералів виходить в атмосферу. Інші молекули газу потрапляють у підземні пастки, у яких накопичуються протягом десятків, сотень мільйонів років. Пастками є пласти пухких порід, порожнечі яких заповнюються газом. Ложем для таких газових колекторів зазвичай є вода і нафта, а зверху їх перекривають газонепроникні товщі щільних порід.
Так як у земній корі мандрують і інші гази (головним чином метан, азот, вуглекислота), і до того ж у значно більших кількостях, то суто гелієвих скупчень не існує. Гелій у природних газах присутня як незначна домішка. Зміст його не перевищує тисячних, сотих, рідко - десятих часток відсотка. Велика (1,5-10%) гелієносність метаноазотних родовищ – явище вкрай рідкісне.
Природні гази виявилися єдиним джерелом сировини для промислового отримання гелію. Для відокремлення від інших газів використовують виняткову леткість гелію, пов'язану з його низькою температурою зрідження. Після того, як всі інші компоненти природного газу сконденсуються при глибокому охолодженні, відкачують газоподібний гелій. Потім його очищають від домішок. Чистота заводського гелію сягає 99,995%.
Запаси гелію на Землі оцінюються в 54 014 м 3 ; судячи з обчислень, його утворилося в земної корі за 2 млрд. років у десятки разів більше. Така розбіжність теорії з практикою цілком зрозуміла. Гелій - легкий газ і, подібно до водню (хоча й повільніше), він випаровується з атмосфери у світовий простір. Ймовірно, за час існування Землі гелій нашої планети неодноразово оновлювався – старий випаровувався в космос, а замість нього в атмосферу надходив свіжий – «видихається» Землею.
У літосфері гелію щонайменше 200 тис. разів більше, ніж у атмосфері; ще більше потенційного гелію зберігається в «утробі» Землі – в альфа-активних елементах. Але загальний зміст цього елемента у Землі та атмосфері невеликий. Гелій - рідкісний та розсіяний газ. На 1 кг земного матеріалу припадає всього 0,003 мг гелію, а вміст його в повітрі – 0,00052 об'ємного відсотка. Така мала концентрація не дозволяє поки що економічно витягувати гелій з повітря.
Інертний, але дуже потрібний гелій
Наприкінці минулого століття англійський журнал «Панч» помістив карикатуру, на якій гелій був зображений хитро підморгуючим чоловічком - сонцем. Текст під малюнком говорив: «Нарешті мене виловили і Землі! Це тривало досить довго! Цікаво знати, скільки часу мине, поки вони здогадаються, що робити зі мною?
Дійсно, минуло 34 роки від дня відкриття земного гелію (перше повідомлення про це було опубліковано в 1881), перш ніж він знайшов практичне застосування. Певну роль тут відіграли оригінальні фізико-технічні, електричні та меншою мірою хімічні властивості гелію, що зажадали тривалого вивчення. Головними перешкодами були розсіяність і висока вартість елемента № 2. Тому практиці гелій був недоступний.
Першими гелій застосували німці. У 1915 р. вони почали наповнювати їм свої дирижаблі, які бомбили Лондон. Незабаром легкий, але негорючий гелій став незамінним наповнювачем повітроплавних апаратів. Занепад дирижаблебудування, що почався в середині 30-х років, спричинив деякий спад у виробництві гелію, але лише на короткий час. Цей газ дедалі більше привертав увагу хіміків, металургів і машинобудівників.
Багато технологічні процеси та операції не можна вести у повітряному середовищі. Щоб уникнути взаємодії речовини, що отримується (або вихідної сировини) з газами повітря, створюють спеціальні захисні середовища; і немає для цього більш відповідного газу, ніж гелій.
Інертний, легкий, рухливий гелій, що добре проводить тепло, - ідеальний засіб для передавлювання з однієї ємності в іншу легкозаймистих рідин і порошків; саме ці функції виконує він у ракетах та керованих снарядах. У гелієвому захисному середовищі проходять окремі стадії одержання ядерного пального. У контейнерах, заповнених гелієм, зберігають та транспортують тепловиділяючі елементи ядерних реакторів. За допомогою особливих шукачів течії, дія яких заснована на винятковій дифузійній здатності гелію, виявляють найменші можливості витоку в атомних реакторах або інших системах, що знаходяться під тиском або вакуумом.
Останні роки ознаменовані повторним підйомом дирижаблебудування, тепер на вищій науково-технічній основі. У ряді країн побудовані та будуються дирижаблі з гелієвим наповненням вантажопідйомністю від 100 до 3000 т. Вони економічні, надійні та зручні для транспортування великогабаритних вантажів, таких, як батоги газопроводів, нафтоочисні установки, опори ліній електропередач тощо. Наповнення з 85% гел. і 15% водню є вогнебезпечним і тільки на 7% знижує підйомну силу в порівнянні з водневим наповненням.
Почали діяти високотемпературні ядерні реактори нового типу, у яких теплоносія служить гелій.
У наукових дослідженнях та техніці широко застосовується рідкий гелій. Наднизькі температури сприяють поглибленому пізнанню речовини та її будови – за більш високих температур тонкі деталі енергетичних спектрів маскуються тепловим рухом атомів.
Вже існують надпровідні соленоїди з особливих сплавів, що створюють за температури рідкого гелію сильні магнітні поля (до 300 тис. ерстед) при мізерних витратах енергії.
При температурі рідкого гелію багато металів і сплавів стають надпровідниками. Надпровідникові реле - кріотрони все ширше використовуються в конструкціях електронно-обчислювальних машин. Вони прості, надійні, дуже компактні. Надпровідники, а з ними рідкий гелій стають необхідними для електроніки. Вони входять до конструкції детекторів інфрачервоного випромінювання, молекулярних підсилювачів (мазерів), оптичних квантових генераторів (лазерів), приладів для вимірювання надвисоких частот.
Звичайно, цими прикладами не вичерпується роль гелію у сучасній техніці. Але якби не обмеженість природних ресурсів, не крайня неуважність гелію, він знайшов би ще безліч застосувань. Відомо, наприклад, що при консервуванні в середовищі гелію харчові продукти зберігають свій первісний смак та аромат. Але «гелієві» консерви поки що залишаються «річчю в собі», тому що гелію не вистачає і застосовують його лише у найважливіших галузях промисловості і там, де без нього ніяк не обійтися. Тому особливо прикро усвідомлювати, що з пальним природним газом через апарати хімічного синтезу, топки та печі проходять і йдуть в атмосферу набагато більші кількості гелію, ніж ті, що видобуваються з гелієносних джерел.
Зараз вважається вигідним виділяти гелій тільки в тих випадках, якщо його вміст у природному газі не менший за 0,05%. Запаси такого газу весь час зменшуються, і не виключено, що їх буде вичерпано ще до кінця нашого століття. Однак проблема «гелієвої недостатності» до цього часу, ймовірно, буде вирішена - частково за рахунок створення нових, більш досконалих методів поділу газів, вилучення з них найбільш цінних, хоч і незначних за обсягом фракцій, і частково завдяки керованому термоядерному синтезу. Гелій стане важливим, хоч і побічним, продуктом діяльності «штучних сонців».
ІЗОТОПИ ГЕЛІЯ, У природі існують два стабільні ізотопи гелію: гелій-3 і гелій-4. Легкий ізотоп поширений Землі в мільйон разів менше, ніж важкий. Це найрідкісніший із стабільних ізотопів, що існують на нашій планеті. Штучним шляхом отримано ще три ізотопи гелію. Усі вони радіоактивні. Період напіврозпаду гелію-5 – 2,440-21 секунди, гелію-6 – 0,83 секунди, гелію-8 – 0,18 секунди. Найважчий ізотоп, цікавий тим, що в його ядрах на один протон припадає три нейтрони, вперше отриманий у Дубні у 60-х роках. Спроби отримати гелій-10 поки що були невдалими.
ОСТАННІЙ ТВЕРДИЙ ГАЗ. У рідкий і твердий стан гелій був переведений останнім із усіх газів. Особливі складності зрідження та затвердіння гелію пояснюються будовою його атома та деякими особливостями фізичних властивостей. Зокрема, гелій, як і водень, за температури вище - 250°C, розширюючись, не охолоджується, а нагрівається. З іншого боку, критична температура гелію вкрай низька. Саме тому рідкий гелій вперше вдалося отримати лише у 1908, а твердий – у 1926 р.
ГЕЛІЄВЕ ПОВІТРЯ. Повітря, в якому весь азот чи більша його частина замінено гелієм, сьогодні вже не новина. Його широко використовують на землі, під землею та під водою.
Гелієве повітря втричі легше і набагато рухоміше звичайного повітря. Він активніше веде себе у легенях – швидко підводить кисень і швидко евакуює вуглекислий газ. Ось чому гелієве повітря дають хворим при розладах дихання та деяких операціях. Він знімає ядухи, лікує бронхіальну астму та захворювання гортані.
Дихання гелієвим повітрям практично виключає азотну емболію (кесонну хворобу), якій при переході від підвищеного тиску до нормального піддаються водолази та фахівці інших професій, робота яких проходить в умовах підвищеного тиску. Причина цієї хвороби – досить значна, особливо при підвищеному тиску, розчинність азоту у крові. У міру зменшення тиску він виділяється у вигляді газових бульбашок, які можуть закупорити кровоносні судини, пошкодити нервові вузли... На відміну від азоту, гелій практично нерозчинний у рідинах організму, тому він не може бути причиною кесонної хвороби. До того ж, гелієве повітря виключає виникнення «азотного наркозу», зовні подібного до алкогольного сп'яніння.
Рано чи пізно людству доведеться навчитися довго жити і працювати на морському дні, щоб всерйоз скористатися мінеральними та харчовими ресурсами шельфу. А на великих глибинах, як показали досліди радянських, французьких та американських дослідників, гелієве повітря поки що незамінне. Біологи довели, що тривале дихання гелієвим повітрям не викликає негативних зрушень у людському організмі та не загрожує змінами в генетичному апараті: гелієва атмосфера не впливає на розвиток клітин та частоту мутацій. Відомі роботи, автори яких вважають гелієве повітря оптимальним повітряним середовищем для космічних кораблів, які здійснюють тривалі польоти у Всесвіт.
НАШ ГЕЛІЙ. У 1980 р. група вчених та фахівців на чолі з І. Л. Андрєєвим була удостоєна Державної премії за створення та впровадження технології отримання гелієвих концентратів із порівняно бідних гелієносних газів. На Оренбурзькому газовому родовищі збудовано гелієвий завод, який став головним нашим постачальником «сонячного газу» для потреб різних галузей.
ГЕЛІЄВИЙ КОМПЛЕКС. У 1978 р. академіку В. А. Легасову зі співробітниками при розпаді ядер тритію, включених в молекулу амінокислоти гліцину, вдалося зареєструвати парамагнітний комплекс, що містить гелій, в якому спостерігалася надтонка взаємодія ядра гелію-3 з неспареним електроном. Це поки що найбільше досягнення в хімії гелію.
Існує три основні джерела отриманнягелію:
- з гелій містять природних газів
- з мінералів
- з повітря
Одержання гелію з природного газу
Основним способом отримання гелію є метод фракційної конденсації з природних газів, що містять гелі, тобто. методом глибокого охолодження. Причому використовується його характерна властивість – найнижча порівняно з відомими речовинами температура кипіння. Це дозволяє конденсувати всі супутні гелію гази, насамперед метан та азот. Процес здійснюється зазвичай у дві стадії:
- виділення так званого сирого гелію (концентрату, що містить 70-90% He)
- очищення із отриманням технічно чистого гелію.
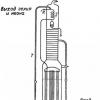
На малюнку нижче наведено одну із схем установки для вилучення гелію з природного газу.
Газ стискається до 25 атмосфер і під цим тиском надходить до установки. Очищення (CO 2 ) і часткова осушка газу проводяться в скруберах, які зрошуються розчином, що містить 10-20% моноетаноламіну, 70-80% діетиленгліколю і 5-10% води. Після скруберів у газі залишається 0,003-0,008% вуглекислоти CO 2 а точка роси не перевищує 5°С. Подальша осушка здійснюється в адсорберах із силікагелем, де досягається температура точки роси -45°С.
Під тиском близько 20 атмосфер чистий сухий газ надходить у попередній теплообмінник 1 де охолоджується до -28° З зворотними газовими потоками. При цьому відбувається конденсація важких вуглеводнів, які відокремлюються в сепараторі 2. В аміачному холодильнику газ 3 охолоджується до -45°С, конденсат відокремлюється в сепараторі 4. В основному теплообміннику 5 температура газу знижується до -110°С, в результаті чого конденсується значна частина метану. Паро-рідинна суміш (близько 20% рідини) дроселюється до тиску 12 атмосфер перший протиточний конденсатор 6, на виході з якого паро-газова суміш збагачується гелієм до 3%. Конденсат, що утворився в трубках, стікає у відпарну секцію, на тарілках якої з рідини видаляється розчинений в ній гелій, що приєднується до паро-газового потоку.
Рідина дроселюється до 1,5 атмосфер у міжтрубний простір конденсатора, де служить холодоагентом. Пар, що утворився тут, виводиться через теплообмінники 5 і 1. Паро-газова суміш, що виходить з конденсатора 6 і містить до 3% He, під тиском 12 атмосфер йде в другий протиточний конденсатор 7, що складається з двох частин: в нижній частині знаходиться змійниковий теплообмінник, трубках якого випаровується сдросельна з 12 до 1,5 атмосфер кубова рідина, а у верхній частині - прямотрубчастий теплообмінник, в міжтрубному просторі якого кипить азот при температурі -203°С і тиску 0,4 атмосфери. В результаті конденсації компонентів газової суміші в нижній частині апарату газ 7 збагачується гелієм до 30-50%, а у верхній частині - до 90-92%.
Сирий гелій такого складу під тиском 11-12 атмосфер надходить у теплообмінники, де нагрівається та виводиться з установки. Оскільки у природному газі містяться невеликі домішки водню, то сирому гелії концентрація водню збільшується до 4-5%. Видалення водню проводять каталітичним гідруванням з подальшим осушуванням газу в адсорберах з силікагелем. Сирий гелій стискається до 150- 200 атмосфер мембранним компресором 8, охолоджується в теплообміннику 9 і надходить у прямоточний конденсатор змійниковий 10, охолоджується азотом, киплячим під вакуумом. Конденсат (рідкий ) збирається в сепараторі 11 і періодично виводиться, а газ, що несконденсувався, містить приблизно 98% He йде в адсорбер 12 з активованим вугіллям, що охолоджується рідким азотом. Гелій, що виходить з адсорбера, містить домішок менше 0,05% і надходить у балони 13 як продукт.
Особливо багаті гелієм природні гази в США, що визначає широке застосування гелію в цій країні.
Одержання гелію з мінералів
Іншим джерелом гелію єдеякі радіоактивні мінералимістять уран, торій та самарій:
- наклеп
- фергюсоніт
- самарскіт
- гадолініт
- монацит
- торіаніт
Зокрема монацитові піски, Велике родовище яких є в Траванкорі (Індія): монацити цього родовища містять близько 1 см 3 гелію в 1 г руди.
Для отримання гелію моноциту необхідно нагріти в закритій посудині моноцит до 1000°С. Гелій виділяється разом із вуглекислим газом (CO 2 ), який потім поглинався розчином їдкого натрію (NaOH). Залишковий газ містить 96,6% He. Подальше очищення проводиться при 600°С на металевому магнії для видалення азоту, а потім при 580°С - на металевому кальції для видалення домішок, що залишилися. Продукційний газ містить понад 99,5% He. З 1000 т монацитового піску можна отримати близько 80 м3 чистого гелію. Такий спосіб отримання гелію не представляє технічного та промислового інтересу..
Отримання гелію з повітря
У невеликій кількості гелій знаходиться у повітрі, з якого він може бути отриманий як побічний продукт при виробництві кисню та азоту з повітря, описаного у статті «». У промислових ректифікаційних колонах для поділу повітря над рідким азотом збирається газоподібна суміш, що залишається, неону і гелію. На малюнку нижче показано апарат Клодаспеціально пристосований для відділення такої суміші.

Газ, що виходить з апарату через вентиль Д, охолоджується в змійовику S, який поливається рідким азотом Т, щоб сконденсувати залишковий азот. Якщо вентиль R трохи відкрити, виходить суміш, що містить дуже мало азоту. При такому методі промислового отримання гелію, крім труднощі, що полягає в необхідності обробити велику кількість повітря, трапляється ще додаткова скрута - необхідність відділення гелію від неону. Це відділення може бути виконане за допомогою рідкого водню, в якому неон твердне, або за допомогою адсорбції неону активованим вугіллям рідким азотом, що охолоджується.
Отримання гелію з повітря недоцільновнаслідок його малої кількості – 0,00046% обсягу або 0,00007% ваги. Розрахунки показують, що вартість одного кубометра гелію, видобутого з повітря, буде у тисячі разів більша, ніж при добуванні його з природних газів. Така висока вартість, звичайно, унеможливлює промислове виділення гелію з повітря.
Наприклад: Щоб видобути 1 кубометр гелію, потрібно виділити 116 т азоту.