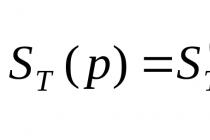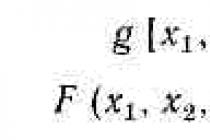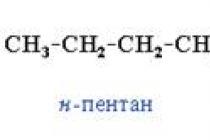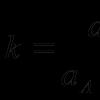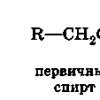Ethylalkohol neboli víno je rozšířeným zástupcem alkoholů. Je známo mnoho látek, které obsahují kyslík spolu s uhlíkem a vodíkem. Ze sloučenin obsahujících kyslík mě zajímá především třída alkoholů.
Ethanol
Fyzikální vlastnosti alkoholu . Ethylalkohol C 2 H 6 O je bezbarvá kapalina zvláštního zápachu, lehčí než voda (měrná hmotnost 0,8), vře při teplotě 78 °, 3, dobře rozpouští mnoho anorganických a organických látek. Alkohol „rektifikovaný“ obsahuje 96 % etylalkoholu a 4 % vody.
Struktura molekuly alkoholu .Podle valence prvků odpovídá vzorec C 2 H 6 O dvěma strukturám:
Abychom vyřešili otázku, který ze vzorců ve skutečnosti odpovídá alkoholu, přejděme ke zkušenosti.
Vložte kousek sodíku do zkumavky s alkoholem. Okamžitě začne reakce doprovázená uvolněním plynu. Není těžké prokázat, že tento plyn je vodík.
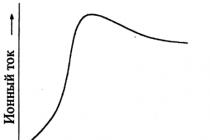
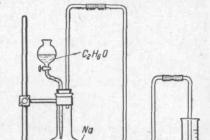
Nyní připravíme experiment tak, abychom mohli určit, kolik atomů vodíku se uvolní během reakce z každé molekuly alkoholu. K tomu přidejte určité množství alkoholu, například 0,1 grammolekuly (4,6 gramu), po kapkách z nálevky do baňky s malými kousky sodíku (obr. 1). Vodík uvolněný z alkoholu vytlačí vodu z dvouhrdlé láhve do odměrného válce. Objem vytlačené vody ve válci odpovídá objemu uvolněného vodíku.

Obr. 1. Kvantitativní zkušenosti se získáváním vodíku z ethylalkoholu.
Protože bylo pro experiment použito 0,1 grammolekuly alkoholu, lze získat vodík (za normálních podmínek) asi 1,12 litrů. To znamená, že sodík vytěsňuje 11,2 litr, tj. půl grammolekuly, jinými slovy 1 gramatom vodíku. V důsledku toho je z každé molekuly alkoholu sodíkem vytlačen pouze jeden atom vodíku.
Je zřejmé, že v molekule alkoholu je tento atom vodíku ve zvláštní pozici ve srovnání s ostatními pěti atomy vodíku. Vzorec (1) neposkytuje vysvětlení pro tuto skutečnost. Všechny atomy vodíku jsou podle ní stejně vázány na atomy uhlíku a jak víme, nejsou vytlačovány kovovým sodíkem (sodík je uložen ve směsi uhlovodíků – v petroleji). Naopak vzorec (2) odráží přítomnost jednoho atomu ve speciální poloze: je připojen k uhlíku přes atom kyslíku. Lze uzavřít, že tento konkrétní atom vodíku je méně pevně vázán k atomu kyslíku; ukazuje se, že je mobilnější a je nahrazen sodíkem. Proto strukturní vzorec ethylalkoholu:

Navzdory větší pohyblivosti atomu vodíku hydroxylové skupiny ve srovnání s jinými atomy vodíku není ethylalkohol elektrolytem a ve vodném roztoku se nedisociuje na ionty.

Aby se zdůraznilo, že molekula alkoholu obsahuje hydroxylovou skupinu - OH, kombinovanou s uhlovodíkovým radikálem, je molekulární vzorec ethylalkoholu napsán následovně:

Chemické vlastnosti alkoholu . Výše jsme viděli, že ethylalkohol reaguje se sodíkem. Když známe strukturu alkoholu, můžeme tuto reakci vyjádřit rovnicí:

Produkt náhrady vodíku v alkoholu sodíkem se nazývá ethylát sodný. Může být izolován po reakci (odpařením přebytečného alkoholu) jako pevná látka.
Když se alkohol zapálí na vzduchu, hoří namodralým, sotva znatelným plamenem a vydává hodně tepla:

Pokud se v baňce s lednicí zahřívá ethanol s kyselinou halogenovodíkovou, např. s HBr (nebo směsí NaBr a H 2 SO 4, která při reakci poskytuje bromovodík), oddestiluje se olejovitá kapalina - ethyl bromid C 2 H 5 Br:

Tato reakce potvrzuje přítomnost hydroxylové skupiny v molekule alkoholu.
Při zahřívání s koncentrovanou kyselinou sírovou jako katalyzátorem se alkohol snadno dehydratuje, to znamená, že odštěpuje vodu (předpona „de“ označuje oddělení něčeho):

Tato reakce se používá k výrobě etylenu v laboratoři. Při slabším zahřívání alkoholu kyselinou sírovou (ne vyšším než 140 °) se každá molekula vody odštěpí od dvou molekul alkoholu, v důsledku čehož se vytvoří diethylether - těkavá hořlavá kapalina:
Diethylether (někdy nazývaný éterová síra) se používá jako rozpouštědlo (čištění tkání) a v lékařství pro anestezii. Patří do třídy ethery - organické látky, jejichž molekuly se skládají ze dvou uhlovodíkových radikálů spojených atomem kyslíku: R - O - R1
Použití ethylalkoholu ... Ethylalkohol má velký praktický význam. Hodně ethylalkoholu se vynakládá na výrobu syntetického kaučuku metodou akademika S. V. Lebedeva. Procházením par ethylalkoholu přes speciální katalyzátor se získá divinyl:
který pak může polymerovat na pryž.
Z lihu se vyrábějí barviva, diethylether, různé „ovocné esence“ a řada dalších organických látek. Alkohol jako rozpouštědlo se používá k výrobě parfémů, mnoha léků. Rozpouštění pryskyřic v alkoholu, připravte různé laky. Vysoká výhřevnost lihu určuje jeho použití jako paliva (automobilové palivo = etanol).
Získání ethylalkoholu . Světová produkce alkoholu se měří v milionech tun ročně.
Běžnou metodou výroby alkoholu je kvašení cukernatých látek za přítomnosti kvasinek. V těchto nižších rostlinných organismech (houbách) se produkují speciální látky - enzymy, které slouží jako biologické katalyzátory fermentační reakce.
Jako výchozí suroviny při výrobě lihu se berou semena obilnin nebo hlízy brambor, bohaté na škrob. Škrob se nejprve pomocí sladu obsahujícího enzym diastázu přemění na cukr, který se následně fermentuje na alkohol.
Vědci tvrdě pracovali na nahrazení potravinářských surovin pro výrobu alkoholu levnějšími nepotravinářskými surovinami. Toto hledání bylo korunováno úspěchem.
V poslední době díky tomu, že při krakování ropy vzniká hodně etylenu, ocel
Hydratační reakci ethylenu (v přítomnosti kyseliny sírové) studovali A.M.Butlerov a V. Gorjainov (1873), kteří rovněž předpověděli její průmyslový význam. Byl také vyvinut a do průmyslu zaveden způsob přímé hydratace ethylenu jeho průchodem ve směsi s vodní párou přes pevné katalyzátory. Výroba alkoholu z etylenu je velmi ekonomická, protože etylen je součástí krakovacích plynů ropy a jiných průmyslových plynů, a proto je široce dostupnou surovinou.
Další metoda je založena na použití acetylenu jako výchozího produktu. Acetylen podléhá hydrataci podle Kucherovovy reakce a vzniklý acetaldehyd je katalyticky redukován vodíkem v přítomnosti niklu na ethylalkohol. Celý proces hydratace acetylenu s následnou redukcí vodíkem na niklovém katalyzátoru na ethylalkohol lze znázornit schématem.
Homologní řada alkoholů
Kromě ethylalkoholu jsou známy další alkoholy, které mají podobnou strukturu a vlastnosti. Všechny lze považovat za deriváty odpovídajících nasycených uhlovodíků, v jejichž molekulách je jeden atom vodíku nahrazen hydroxylovou skupinou:
stůl
|
Uhlovodíky |
Alkoholy |
Bod varu alkoholů ve º С |
| Metan CH 4 | Methyl CH30H | 64,7 |
| Ethan C2H6 | Ethyl C2H5OH nebo CH3-CH2-OH | 78,3 |
| Propan C3H8 | Propyl С 4 Н 7 ОН nebo СН 3 - СН 2 - СН 2 - ОН | 97,8 |
| Butan C4H10 | Butyl C4H9OH nebo CH3-CH2-CH2-OH | 117 |
Vzhledem k podobným chemickým vlastnostem a navzájem se lišícím složením molekul na skupinu atomů CH2 tvoří tyto alkoholy homologní řadu. Porovnáním fyzikálních vlastností alkoholů sledujeme v této řadě, stejně jako v řadě uhlovodíků, přechod kvantitativních změn na změny kvalitativní. Obecný vzorec alkoholů této řady je R - OH (kde R je uhlovodíkový radikál).
Jsou známy alkoholy, jejichž molekuly obsahují několik hydroxylových skupin, např.

Skupiny atomů, které určují charakteristické chemické vlastnosti sloučenin, tedy jejich chemickou funkci, se nazývají funkční skupiny.
Alkoholy jsou organické látky, jejichž molekuly obsahují jednu nebo více funkčních hydroxylových skupin navázaných na uhlovodíkový radikál .
Svým složením se alkoholy od uhlovodíků, jim odpovídajících počtem atomů uhlíku, liší přítomností kyslíku (například C 2 H 6 a C 2 H 6 O nebo C 2 H 5 OH). Proto lze alkoholy považovat za produkty částečné oxidace uhlovodíků.
Genetický vztah mezi uhlovodíky a alkoholy
Je poměrně obtížné přímo oxidovat uhlovodík na alkohol. V praxi je snazší to provést pomocí halogenovaného uhlovodíku. Například pro získání ethylalkoholu, počínaje ethanem C2H6, můžete nejprve získat ethylbromid reakcí:
a poté přeměňte ethylbromid na alkohol zahříváním s vodou v přítomnosti alkálie:
V tomto případě je potřeba alkálie k neutralizaci vzniklého bromovodíku a vyloučení možnosti jeho reakce s alkoholem, tzn. posuňte tuto vratnou reakci doprava.
Podobným způsobem lze získat methylalkohol podle schématu:
Uhlovodíky, jejich halogenderiváty a alkoholy jsou tedy v genetickém vztahu (vztah podle původu).
V závislosti na typu uhlovodíkového radikálu a v některých případech také na zvláštnostech připojení -OH skupiny k tomuto uhlovodíkovému radikálu se sloučeniny s hydroxylovou funkční skupinou dělí na alkoholy a fenoly.
Alkoholy[0023] Termín "sloučenina" označuje sloučeniny, ve kterých je hydroxylová skupina připojena k uhlovodíkovému radikálu, ale není přímo připojena k aromatickému jádru, pokud je ve struktuře radikálu.
Příklady alkoholů:
Pokud struktura uhlovodíkového radikálu obsahuje aromatické jádro a hydroxylovou skupinu, přičemž je připojena přímo k aromatickému jádru, jsou takové sloučeniny tzv. fenoly .
Příklady fenolů:
Proč jsou fenoly izolovány ve třídě oddělené od alkoholů? Ostatně třeba ty vzorce

jsou velmi podobné a působí dojmem látek stejné třídy organických sloučenin.
Přímé spojení hydroxylové skupiny s aromatickým jádrem však významně ovlivňuje vlastnosti sloučeniny, neboť konjugovaný systém π-vazeb aromatického jádra je konjugován i s jedním z osamocených elektronových párů atomu kyslíku. Z tohoto důvodu je vazba O-H ve fenolech polárnější než v alkoholech, což výrazně zvyšuje pohyblivost atomu vodíku v hydroxylové skupině. Jinými slovy, fenoly mají výrazně výraznější kyselé vlastnosti než alkoholy.
Chemické vlastnosti alkoholů
Jednosytné alkoholy
Substituční reakce
Substituce atomu vodíku v hydroxylové skupině
1) Alkoholy reagují s alkáliemi, kovy alkalických zemin a hliníkem (čištěným z ochranného filmu Al 2 O 3), přičemž vznikají alkoholáty kovů a uvolňuje se vodík:
Tvorba alkoholátů je možná pouze při použití alkoholů, které neobsahují rozpuštěnou vodu, protože v přítomnosti vody se alkoholáty snadno hydrolyzují:
CH3OK + H20 = CH3OH + KOH
2) Esterifikační reakce
Esterifikační reakce je interakce alkoholů s organickými a anorganickými kyselinami obsahujícími kyslík, což vede ke vzniku esterů.
Tento typ reakce je reverzibilní, proto je pro posunutí rovnováhy směrem k tvorbě esteru žádoucí provádět reakci za zahřívání a také v přítomnosti koncentrované kyseliny sírové jako dehydratačního činidla:
Substituce hydroxylové skupiny
1) Působením halogenovodíkových kyselin na alkoholy je hydroxylová skupina nahrazena atomem halogenu. V důsledku této reakce se tvoří halogenalkany a voda:
2) Při průchodu směsi alkoholových par s amoniakem zahřátými oxidy některých kovů (nejčastěji Al 2 O 3) lze získat primární, sekundární nebo terciární aminy:
Typ aminu (primární, sekundární, terciární) bude do určité míry záviset na poměru výchozího alkoholu k amoniaku.
Eliminační (štěpící) reakce
Dehydratace
Dehydratace, což vlastně znamená eliminaci molekul vody, se v případě alkoholů liší o intermolekulární dehydratace a intramolekulární dehydratace.
Na intermolekulární dehydratace alkoholů, vzniká jedna molekula vody jako výsledek eliminace atomu vodíku z jedné molekuly alkoholu a hydroxylové skupiny z jiné molekuly.
V důsledku této reakce se tvoří sloučeniny patřící do třídy etherů (R-O-R):
Intramolekulární dehydratace alkoholů probíhá tak, že se od jedné molekuly alkoholu odštěpí jedna molekula vody. Tento typ dehydratace vyžaduje poněkud přísnější podmínky, spočívající v nutnosti použít znatelně silnější ohřev ve srovnání s mezimolekulární dehydratací. V tomto případě se z jedné molekuly alkoholu vytvoří jedna molekula alkenu a jedna molekula vody:
Protože molekula metanolu obsahuje pouze jeden atom uhlíku, intramolekulární dehydratace je pro ni nemožná. Při dehydrataci methanolu může vzniknout pouze ether (CH 3 -O-CH 3).
Je třeba jasně pochopit skutečnost, že v případě dehydratace asymetrických alkoholů bude intramolekulární eliminace vody probíhat v souladu se Zaitsevovým pravidlem, tzn. vodík se odštěpí od nejméně hydrogenovaného atomu uhlíku:
Dehydrogenace alkoholů
a) Dehydrogenace primárních alkoholů při zahřívání v přítomnosti kovové mědi vede k tvorbě aldehydy:
b) V případě sekundárních alkoholů povedou ke vzniku podobné podmínky ketony:
c) Terciární alkoholy nevstupují do podobné reakce, tzn. nepodléhají dehydrogenaci.
Oxidační reakce
Spalování
Alkoholy snadno podléhají spalovacím reakcím. To produkuje velké množství tepla:
2СН 3 -ОН + 3O 2 = 2CO 2 + 4H 2 O + Q
Neúplná oxidace
Neúplná oxidace primárních alkoholů může vést ke vzniku aldehydů a karboxylových kyselin.
V případě neúplné oxidace sekundárních alkoholů mohou vznikat pouze ketony.
Neúplná oxidace alkoholů je možná, když na ně působí různá oxidační činidla, například vzdušný kyslík v přítomnosti katalyzátorů (kovová měď), manganistan draselný, dichroman draselný atd.
V tomto případě lze aldehydy získat z primárních alkoholů. Jak vidíte, oxidace alkoholů na aldehydy ve skutečnosti vede ke stejným organickým produktům jako dehydrogenace:
Je třeba poznamenat, že při použití oxidantů, jako je manganistan draselný a dichroman draselný v kyselém prostředí, je možná hlubší oxidace alkoholů, konkrétně na karboxylové kyseliny. Zejména se to projevuje při použití přebytku oxidačního činidla při zahřívání. Sekundární alkoholy mohou být za těchto podmínek oxidovány pouze na ketony.
NEJLEPŠÍ MULTI-ATOMOVÉ ALKOHOLY
Náhrada atomů vodíku za hydroxylové skupiny
Vícesytné alkoholy i jednosytné alkoholy reagovat s alkáliemi, kovy alkalických zemin a hliníkem (odloupnutým z filmuAl 2 Ó 3 ); v tomto případě může být nahrazen jiný počet atomů vodíku hydroxylových skupin v molekule alkoholu:
2. Protože molekuly vícesytných alkoholů obsahují několik hydroxylových skupin, ovlivňují se navzájem negativním indukčním účinkem. To vede zejména k oslabení vazby O — H a zvýšení kyselých vlastností hydroxylových skupin.
B Ó Vyšší kyselost vícesytných alkoholů se projevuje tím, že vícesytné alkoholy na rozdíl od jednosytných reagují s některými hydroxidy těžkých kovů. Musíte si například pamatovat skutečnost, že čerstvě vysrážený hydroxid měďnatý reaguje s vícemocnými alkoholy za vzniku jasně modrého roztoku komplexní sloučeniny.
Interakce glycerinu s čerstvě vysráženým hydroxidem měďnatým tedy vede k vytvoření jasně modrého roztoku glycerátu mědi:
Tato reakce je vysoká kvalita pro vícemocné alkoholy. Ke složení zkoušky stačí znát známky této reakce a není nutné umět zapsat samotnou interakční rovnici.
3. Stejně jako jednosytné alkoholy mohou do esterifikační reakce vstupovat i vícesytné alkoholy, tzn. reagovat s organickými a anorganickými kyselinami obsahujícími kyslík s tvorbou esterů. Tato reakce je katalyzována silnými anorganickými kyselinami a je vratná. V tomto ohledu se během esterifikační reakce výsledný ester oddestiluje z reakční směsi, aby se rovnováha posunula doprava podle Le Chatelierova principu:
Pokud karboxylové kyseliny s velkým počtem atomů uhlíku v uhlovodíkovém radikálu, které jsou výsledkem takové reakce, vstoupí do reakce s glycerolem, estery se nazývají tuky.
V případě etherifikace alkoholů kyselinou dusičnou se používá tzv. nitrační směs, což je směs koncentrované kyseliny dusičné a sírové. Reakce se provádí za stálého chlazení:
Ester glycerinu a kyseliny dusičné, nazývaný trinitroglycerin, je výbušnina. Kromě toho má 1% roztok této látky v alkoholu silný vazodilatační účinek, který se z lékařských důvodů používá k prevenci záchvatu mrtvice nebo srdečního infarktu.
Substituce hydroxylových skupin
Reakce tohoto typu probíhají podle mechanismu nukleofilní substituce. Mezi interakce tohoto druhu patří reakce glykolů s halogenovodíky.
Tak například reakce ethylenglykolu s bromovodíkem probíhá s postupným nahrazením hydroxylových skupin atomy halogenu:
Chemické vlastnosti fenolů
Jak již bylo zmíněno na samém začátku této kapitoly, chemické vlastnosti fenolů se výrazně liší od chemických vlastností alkoholů. To je způsobeno skutečností, že jeden z osamocených elektronových párů atomu kyslíku v hydroxylové skupině je konjugován s π-systémem konjugovaných vazeb aromatického kruhu.
Reakce zahrnující hydroxylovou skupinu
Kyselé vlastnosti
Fenoly jsou silnější kyseliny než alkoholy a jsou velmi málo disociované ve vodném roztoku:
B Ó Vyšší kyselost fenolů ve srovnání s alkoholy z hlediska chemických vlastností je vyjádřena tím, že fenoly jsou na rozdíl od alkoholů schopny reagovat s alkáliemi:
Kyselé vlastnosti fenolu jsou však méně výrazné než dokonce i jedna z nejslabších anorganických kyselin – uhličitá. Takže zejména oxid uhličitý, když prochází vodným roztokem fenolátů alkalických kovů, vytěsňuje z nich volný fenol jako ještě slabší kyselinu než kyselina uhličitá:
Je zřejmé, že fenol bude také nahrazen z fenolátů jakoukoli jinou silnější kyselinou:
3) Fenoly jsou silnější kyseliny než alkoholy a alkoholy reagují s alkalickými kovy a kovy alkalických zemin. V tomto ohledu je zřejmé, že s těmito kovy budou reagovat i fenoly. Jediná věc je, že na rozdíl od alkoholů vyžaduje reakce fenolů s aktivními kovy zahřívání, protože fenoly i kovy jsou pevné látky:
Substituční reakce v aromatickém jádru
Hydroxylová skupina je substituentem prvního druhu, což znamená, že usnadňuje výskyt substitučních reakcí v orto- a pár- pozice ve vztahu k sobě. Reakce s fenolem probíhají za mnohem mírnějších podmínek než s benzenem.
Halogenace
Reakce s bromem nevyžaduje žádné zvláštní podmínky. Když se bromová voda smíchá s roztokem fenolu, okamžitě se vytvoří bílá sraženina 2,4,6-tribromfenolu:
Nitrace
Když je fenol vystaven směsi koncentrované kyseliny dusičné a sírové (nitrační směs), vzniká 2,4,6-trinitrofenol - krystalická žlutá výbušnina:
Adiční reakce
Protože fenoly jsou nenasycené sloučeniny, je možná jejich hydrogenace v přítomnosti katalyzátorů na odpovídající alkoholy.
Alkoholy jsou rozmanitou a rozsáhlou třídou chemických sloučenin.
Alkoholy jsou chemické sloučeniny, jejichž molekuly obsahují OH hydroxylové skupiny navázané na uhlovodíkový radikál.
Uhlovodíkový radikál je složen z atomů uhlíku a vodíku. Příklady uhlovodíkových radikálů - CH3 - methyl, C2H5 - ethyl. Uhlovodíkový radikál je často jednoduše označen písmenem R. Pokud jsou však ve vzorci přítomny různé radikály, označují se R", R ", R" "" atd.
Názvy alkoholů se tvoří přidáním koncovky -ol k názvu odpovídajícího uhlovodíku.
Klasifikace alkoholů

Alkoholy jsou jednoatomové a víceatomové. Pokud je v molekule alkoholu pouze jedna hydroxylová skupina, pak se takový alkohol nazývá jednosytný. Pokud je počet hydroxylových skupin 2, 3, 4 atd., jedná se o vícesytný alkohol.
Příklady jednosytných alkoholů: CH3-OH - methanol nebo methylalkohol, CH3CH2-OH - ethanol nebo ethylalkohol.
V molekule dvojmocného alkoholu jsou tedy přítomny dvě hydroxylové skupiny, v molekule trojmocného alkoholu tři hydroxylové skupiny atd.
Jednosytné alkoholy
Obecný vzorec pro jednosytné alkoholy může být reprezentován jako R-OH.
Podle typu volného radikálu obsaženého v molekule se jednosytné alkoholy dělí na nasycené (nasycené), nenasycené (nenasycené) a aromatické alkoholy.
V nasycených uhlovodíkových radikálech jsou atomy uhlíku spojeny jednoduchými vazbami C - C. V nenasycených radikálech je jeden nebo více párů atomů uhlíku spojených dvojnými vazbami C = C nebo trojnými vazbami C C.
Složení nasycených alkoholů zahrnuje omezující radikály.
CH 3 CH 2 CH 2 -OH - nasycený alkohol propanol-1 nebo propylen alkohol.
Nenasycené alkoholy tedy obsahují nenasycené radikály.
CH2 = CH-CH2-OH - nenasycený alkohol propenol 2-1 (allylalkohol)
A molekula aromatických alkoholů zahrnuje benzenový kruh C6H5.
C 6 H 5 -CH 2 -OH - aromatický alkohol fenylmethanol (benzylalkohol).
V závislosti na typu atomu uhlíku spojeného s hydroxylovou skupinou se alkoholy dělí na primární ((R-CH 2 -OH), sekundární (R-CHOH-R ") a terciární (RR" R "" C-OH) alkoholy .
Chemické vlastnosti jednosytných alkoholů

1. Alkoholy hoří za vzniku oxidu uhličitého a vody. Při spalování vzniká teplo.
C2H5OH + 302 -> 2C02 + 3H20
2. Při reakci alkoholů s alkalickými kovy vzniká alkoholát sodný a uvolňuje se vodík.
C2H5-OH + 2Na -> 2C2H5ONa + H2
3. Reakce s halogenovodíkem. V důsledku reakce vzniká halogenalkan (bromethan a voda).
C2H5OH + HBr -> C2H5Br + H20
4. Při zahřátí a pod vlivem koncentrované kyseliny sírové dochází k intramolekulární dehydrataci. Výsledkem je nenasycený uhlovodík a voda.
H3-CH2-OH -> CH2 = CH2 + H20
5. Oxidace alkoholů. Alkoholy za normálních teplot neoxidují. Ale s pomocí katalyzátorů a při zahřívání dochází k oxidaci.
Vícesytné alkoholy
Jako látky obsahující hydroxylové skupiny mají vícesytné alkoholy chemické vlastnosti podobné vlastnostem jednosytných alkoholů, ale reagují najednou prostřednictvím několika hydroxylových skupin.
Vícesytné alkoholy reagují s aktivními kovy, s halogenovodíkovými kyselinami, s kyselinou dusičnou.
Získávání alkoholů

Uvažujme způsoby získávání alkoholů na příkladu ethanolu, jehož vzorec je C 2 H 5 OH.
Nejstarší z nich je destilace alkoholu z vína, kde vzniká v důsledku kvašení cukernatých látek. Surovinou pro výrobu etylalkoholu jsou také produkty obsahující škrob, které se fermentačním procesem přeměňují na cukr, který je následně fermentován na alkohol. Ale výroba etylalkoholu tímto způsobem vyžaduje velkou spotřebu potravinářských surovin.
Syntetická metoda výroby ethylalkoholu je mnohem dokonalejší. V tomto případě je etylen hydratován vodní párou.
C2H4 + H20 -> C2H5OH
Z vícesytných alkoholů je nejznámější glycerin, který se získává štěpením tuků nebo synteticky z propylenu, který vzniká při vysokoteplotní rafinaci ropy.
cíle:
- Pedagogové: Seznámit studenty s klasifikací alkoholů, jejich nomenklaturou a izomerií. Zvažte vliv struktury alkoholů na jejich vlastnosti. Rozvíjení: Upevnit dovednosti práce ve skupinách, rozvíjet dovednosti k nalezení vztahu mezi novým a naučeným materiálem. Výchovné: formování dovedností týmové práce Žák - student, Žák - učitel. Umět analyzovat obdržené informace.
Typ lekce: Kombinovaný
Organizační forma: frontální průzkum, laboratorní práce, samostatná práce, konverzace na problematické otázky, analýza získaných informací.
Zařízení:
1. Sada snímků ( Příloha 1) tabulky, jednotlivé listy se zadáním pro samostatnou práci, zadáním pro laboratorní práci.
2. Na studentských stolech: láhve s alkoholy (ethyl, isopropyl, glycerin), sodík, oxid měďnatý (2), kyselina octová, fenolftalein, manganistan draselný, písek, hydroxid sodný, kyselina chlorovodíková, voda z vodovodu, chemické nádobí, bezpečnostní předpisy . ..
Plán lekce:
1. 1. Stanovení třídy alkoholů, struktura molekuly jednoatomových nasycených alkoholů.
2. Klasifikace alkoholů ze tří důvodů.
3. Názvosloví alkoholů.
4. Druhy izomerií jednoatomových nasycených alkoholů.
5. Fyzikální vlastnosti alkoholů. Vliv vodíkových vazeb na fyzikální vlastnosti alkoholů.
2. 6. Chemické vlastnosti.
7. Zajištění nového materiálu.
BĚHEM lekcí
I. Organizační moment
Učitel: Dokončili jsme studium velké třídy organických sloučenin, které se skládají pouze ze dvou chemických prvků – uhlíku a vodíku. Jaké další chemické prvky se nejčastěji vyskytují v organických sloučeninách?
Student: Kyslík, dusík, fosfor, síra a další.
II. Učení nového materiálu
Učitel: Začínáme studovat novou třídu organických sloučenin, které kromě uhlíku a vodíku zahrnují kyslík. Říká se jim okysličené. (Snímek číslo 1).
Jak vidíte, existuje několik tříd organických sloučenin sestávajících z uhlíku, vodíku a kyslíku. Dnes začínáme studovat třídu s názvem "Alkoholy". Molekuly alkoholu obsahují hydroxylovou skupinu, která je funkční skupinou (FG) pro tuto třídu. Jak říkáme FG? (Snímek číslo 1).
Student: Skupina atomů (nebo atom), které určují příslušnost sloučeniny k určité třídě a určují její nejdůležitější chemické vlastnosti, se nazývá FG.
Učitel: Alkoholy jsou třídou organických sloučenin, které mají širokou škálu a vlastnosti a jsou široce používány v různých oblastech národního hospodářství. (Snímky číslo 2–8)
Jak vidíte, jedná se o farmacii, výrobu kosmetiky, potravinářský průmysl a také jako rozpouštědlo při výrobě plastů, laků, barev atd. Podívejte se na tabulku.
Stůl 1.
NĚKTERÉ Z NEJDŮLEŽITĚJŠÍCH DUCHŮ
Učitel: Pokud mluvíme o vlivu na lidský organismus, tak všechny alkoholy jsou jedy. Molekuly alkoholu mají škodlivý účinek na živé buňky. (Snímek č. 9) Spits - alkany mají zastaralý název pro alkohol. Alkoholy jsou deriváty uhlovodíků, ve kterých je jeden nebo více atomů vodíku nahrazeno hydroxylovými skupinami - OH.
V nejjednodušším případě lze strukturu alkoholu vyjádřit následujícím vzorcem:
R - OH,
kde R je uhlovodíkový zbytek.
Alkohol lze klasifikovat třemi způsoby:
1. Počet hydroxylových skupin (jednoatomové, dvouatomové, víceatomové).
Tabulka 2
KLASIFIKACE ALKOHOLU PODLE POČTU HYDROXYLOVÝCH SKUPIN (–OH)

2. Povaha uhlovodíkového radikálu (limitní, nenasycený, aromatický).
Tabulka 3
KLASIFIKACE ALKOHOLU PODLE RADIKÁLNÍHO CHARAKTERU

3. Povaha atomu uhlíku, na který je hydroxylová skupina navázána (primární, sekundární, terciární)
Tabulka 4.
KLASIFIKACE ALKOHOLU PODLE CHARAKTERU ATOMU UHLÍKU SPOJENÁ S FUNKČNÍ SKUPINOU –ON

Kvartérní alkoholy neexistují, protože kvartérní atom C je vázán na 4 další atomy C, takže již neexistují žádné valence pro vazbu s hydroxylovou skupinou.
Podívejme se na základní principy konstrukce názvů alkoholů podle substituční nomenklatury pomocí schématu:
Název alkoholu = název HC + (předpona) + - OL +(n1, n2 ..., nn), kde předpona označuje počet –OH skupin v molekule: 2 - "di", 3 - "tři", 4 - "tetra" atd.
n označuje polohu hydroxylových skupin v uhlíkovém řetězci, například:

Pořadí sestavování názvu:
1. Uhlíkový řetězec se čísluje od konce, ke kterému je –OH skupina blíže.
2. Hlavní řetězec obsahuje 7 atomů C, což znamená odpovídající HC heptan.
3. Počet skupin –OH je roven 2, předpona je „di“.
4. Hydroxylové skupiny se nacházejí na 2 a 3 atomech uhlíku, n = 2 a 4.
Název alkoholu je heptandiol-2,4

V našem školním kurzu budeme podrobně studovat jednoatomové nasycené alkoholy s obecným vzorcem: CnH2n + 1OH
Uvažujme modely molekul jednotlivých zástupců těchto alkoholů (methyl, ethyl, glycerin). (Snímky číslo 10-13)
Homologická řada tyto alkoholy začínají methylalkoholem:
CH3 - OH - methylalkohol
CH3 - CH2 - OH - ethylalkohol
CH3 - CH2 - CH2 - OH - propylalkohol
CH3 - CH2 - CH2 - CH2 - OH - butylalkohol
CH3 - CH2 - CH2 - CH2 - CH2 - OH - amyl alkohol nebo pentanol
izomerismus
Nasycené jednosytné alkoholy jsou charakterizovány následujícím typy izomerie:
1) pozice funkčních skupin

2) uhlíková kostra.

Pozorovat- číslování atomů uhlíku začíná od konce blízko skupiny –OH.
3) mezitřídní izomerie (s ethery R - O - R)

Fyzikální vlastnosti alkoholů
Prvních deset členů homologní řady zástupců jednosytných alkoholů jsou kapaliny, vyšší alkoholy jsou pevné látky. (Snímky 14, 15)
Silný vliv na fyzikální vlastnosti alkoholů má vodíková vazba vytvořená mezi molekulami alkoholu. Znáte vodíkové vazby v učebním plánu 9. ročníku, téma „Amoniak“. Nyní nám váš spolužák, který v minulé hodině dostal individuální úkol, připomene, co je vodíková vazba.
Odpověď studentů
Vodíková vazba je vazba mezi atomy vodíku jedné molekuly a velmi elektronegativními atomy jiné molekuly. (F, O, N, CL). V písmenu je označena třemi tečkami. (Snímky 16,17). Vodíková vazba je speciální typ mezimolekulární vazby, která je 10-20x slabší než obvyklá kovalentní vazba, ale má velký vliv na fyzikální vlastnosti sloučenin.
Dva důsledky vodíkové vazby: 1) dobrá rozpustnost látek ve vodě; 2) zvýšení bodů tání a varu. Například: závislost teploty varu některých sloučenin na přítomnosti vodíkové vazby.

Učitel: Jaké závěry můžeme vyvodit o vlivu vodíkových vazeb na fyzikální vlastnosti alkoholů?
studenti: 1) V přítomnosti vodíkové vazby se bod varu velmi zvyšuje.
2) Čím větší atomicita alkoholu, tím více vodíkových vazeb se tvoří.
Zvyšuje také bod varu.
CHEMICKÉ VLASTNOSTI ALKOHOLU
(Opakujte PTB)
Spalování alkoholů.
2. Interakce alkoholů s alkalickými kovy.
3. Oxidace alkoholů (kvalitativní reakce) - získávání aldehydů.
4. Interakce alkoholů s kyselinami za vzniku esterů (esterifikační reakce).
5. Intramolekulární dehydratace alkoholů za vzniku nenasycených uhlovodíků.
6. Mezimolekulární dehydratace alkoholů za vzniku etherů.
7. Dehydrogenace alkoholů - získávání aldehydů.
Učitel: sestavit verš o pěti řádcích (sinkwine)
1. klíčové slovo
2. dvě přídavná jména
3. tři slovesa
4. věta
5. slovo spojené s klíčovým slovem.
Student. Alkoholy.
Jedovatý, tekutý
Zasáhnout, zničit, zničit
Na lidský organismus působí narkoticky.
Drogy.
IV. Domácí práce: odstavec č. 9, str. 66-70, ex. č. 13 b.
Jednotlivé úkoly. Pomocí doplňkové literatury: 1) povězte o oblastech použití glycerinu a etylenglykolu; 2) mluvit o získávání alkoholů z celulózy a tuků; 3) jak tyto alkoholy působí na lidský organismus?
V. Shrnutí lekce shrňme si to v podobě výkonu samostatné práce ve dvou variantách
Literatura:
1. Třída z chemie 10. Učebnice pro všeobecně vzdělávací instituce. Drop Moskva 2008. Základní úroveň 4. vyd. stereotypní.
2. Chemie class 100 pracovní sešit k učebnici. Základní úroveň. Drop, 2007.
3. Rozvoj lekce v chemii. K učebnicím O. S. Gabrielyana,. Stupeň 10
4., . Chemie Grade 9 Smolensk Association XXI století 2006
5. CHEMIE. Nový účet manuál pro ty, kteří vstupují na vysoké školy. Ed. 4., opraveno a doplněno. Rostov na Donu. Phoenix 2007.
1. Klasifikace hydroxyderivátů uhlovodíků.
2. Nasycené jednosytné alkoholy (alkanoly).
3. Vícesytné alkoholy.
4. Fenoly.
5. Ethery.
Hydroxylové deriváty uhlovodíků jsou sloučeniny, které vznikají jako výsledek nahrazení jednoho nebo více atomů vodíku v molekule uhlovodíku hydroxylovými skupinami.
Hydroxylové deriváty uhlovodíků s vazbou C (sp 3) -OH se nazývají alkoholy. Jsou to nasycené alifatické a cyklické alkoholy, například CH 3 OH a,
nenasycené alkoholy, například CH 2 = CH-CH 2 -OH, aromatické alkoholy -
Hydroxylové deriváty obsahující vazbu C (sp 2) -OH se nazývají enoly R-CH = CH-OH a fenoly
Podle počtu hydroxylových skupin obsažených v molekule mohou být alkoholy a fenoly jedno (jedna OH-skupina) -, dvě (dvě OH-skupiny) -, tří- a víceatomové.
Být v přírodě. Na rozdíl od halogenovaných uhlovodíků, alkoholů a fenolů jsou jejich deriváty široce zastoupeny v rostlinném a živočišném světě.
Vyšší alkoholy se nacházejí ve volné formě (například cetylalkohol C 16 H 33 OH), jako součást esterů s vyššími mastnými kyselinami (spermaceti, vosky). Nenasycené alkoholy jsou součástí éterických olejů. Přírodní cyklické alkoholy jsou mentol a cholesterol. Glycerin se nachází v přírodních rostlinných a živočišných tucích a olejích.
Fenoly a jejich ethery se nacházejí v esenciálních olejích mnoha vonných rostlin, jako je tymián, tymián, kmín, anýz, estragon, kopr atd. Polyatomické fenoly a jejich deriváty - aromatické látky rostlin (například hřebíček, muškátový oříšek), složka rostlinných glykosidů, třísloviny čaje, kávy aj.
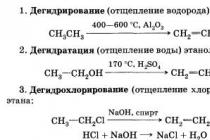
1. Nasycené jednosytné alkoholy (alkanoly).
Obecný vzorec je C n H 2 n + 1 OH.
Nomenklatura. Podle nomenklatury substituentů se hydroxylová skupina v názvu alkoholů označuje příponou - ol. Podle radikálně funkční nomenklatury je radikál uveden v názvu a přidán - nový alkohol: C2H5OH - ethanol nebo ethyl nový alkohol,
CH 3-CH 2-CH 2-OH - propanol-1 nebo pil nový alkohol.
Příjem:
a) hydrolýza halogenalkanů. Halogenalkany při reakcích s vodou nebo vodným roztokem alkálie snadno tvoří alkoholy (viz „Halogenované uhlovodíky“):
C 2 H 5 Br + NaOH (vodný roztok) → C2H5OH + NaBr.
b) hydratace alkenů. K přidání vody k alkenům dochází v přítomnosti katalyzátoru (viz „Alkeny“):
CH2 = CH2 + H-OH CH3-CH2-OH.
c) hydrogenace karbonylových sloučenin.
Katalytická hydrogenace aldehydů a ketonů vede k tvorbě alkoholů (viz „Aldehydy a ketony“):
CH3-CH = O + H2 -> CH3-CH2-OH

Katalyzátory: Ni, Pt, Pd.
d) reakce organohořečnatých sloučenin. K přidání organohořečnatých sloučenin k aldehydům a ketonům dochází snadno (viz „Aldehydy a ketony“):
Primární alkohol se tvoří z methanalu, sekundární alkoholy se tvoří z aldehydů a terciární alkoholy se tvoří z ketonů.
Zvláštnost reakcí tohoto typu - reakční produkty - alkoholy obsahují více atomů uhlíku ve srovnání s výchozími karbonylovými sloučeninami.
e) hydrogenace oxidu uhelnatého (II). V závislosti na povaze katalyzátoru a reakčních podmínkách se získá methanol nebo směs různých alkoholů (synthol): CO + 2H 2 → CH 3 -OH.
Katalyzátory: ZnO, Co a další.
f) alkoholové kvašení sacharidů. Glukóza v přítomnosti kvasinek podléhá fermentaci za vzniku ethylalkoholu a oxidu uhličitého: C 6 H 12 O 6 → 2CH 3 -CH 2 -OH + 2CO 2
izomerismus. Pro nasycené alkoholy je charakteristická strukturní izomerie: izomerie uhlíkového řetězce, umístění hydroxylové skupiny v řetězci. Podle polohy hydroxylové skupiny v řetězci se rozlišují primární (R-CH 2 -OH), sekundární (R 2 CH-OH) a terciární (R 3 C-OH) alkoholy.
Mezitřídní izomerie (metamerie) je charakteristická pro alkoholy, ethery obecného vzorce R-O-R jsou izomery k alkoholům.
CH 3 -CH 2 - CH OH-CH3 (viz "Optická izomerie").
Struktura. V alkoholech jsou atomy uhlíku a kyslíku v sp 3 - hybridizace. Alkoholy obsahují dvě polární σ-vazby: C-O (sp 3 -sp 3 -překrývající se) a O-H (sp 3 -s -překrývající se). Dipóly těchto vazeb směřují k atomu kyslíku a dipólový moment vazby O – H je vyšší než u vazby C – O. Alkanoly jsou polární sloučeniny:
Spojení molekul alkoholu se provádí tvorbou mezimolekulárních vodíkových vazeb:

V důsledku toho mají alkoholy ve srovnání s uhlovodíky a halogenovanými uhlovodíky vyšší teploty varu a tání. Vznik vodíkových vazeb mezi molekulami alkoholů a vodou podporuje rozpouštění těchto sloučenin ve vodě.
Chemické vlastnosti.
Chemické vlastnosti alkoholů jsou způsobeny přítomností v molekule polárních vazeb C-O a O-H a osamocených elektronových párů na atomu kyslíku.
a) kyselé vlastnosti
Alkoholy jsou slabé O-H-kyseliny. Rozsah kyselosti: RСООН> НОН> RОН.
Ve vodném roztoku se kyselost samotných alkoholů snižuje v následujícím směru: methanol> primární> sekundární> terciární.
Kyselé vlastnosti alkoholů se projevují tvorbou solí (alkoholátů nebo alkoxidů) při interakci s kovy:
2C 2 H 5 OH + 2Nа → 2 C 2 H 5 O - Na + + H 2
ethanol ethylát (ethoxid) sodný
Ve vodných roztocích se soli hydrolyzují za vzniku alkoholů a alkálií:
C 2H 5O - Na + + HOH → C 2H 5OH + NaOH
b) základní a nukleofilní vlastnosti
Základní a nukleofilní vlastnosti alkoholů jsou způsobeny osamoceným elektronovým párem na atomu kyslíku.
Hlavní vlastnosti se zvyšují v následujícím směru
methanol< первичные < вторичные < третичные спирты и проявляются в образовании оксониевых солей: С 2 Н 5 ОН + Н + → С 2 Н 5 ОН 2 + . Образование оксониевых солей играет важную роль в реакциях нуклеофильного замещения и отщепления.
Alkoholy jsou tedy amfoterní sloučeniny.
V reakcích se projevují slabé nukleofilní vlastnosti alkoholů a alkoholátů
Alkylace - interakce s alkoholy a alkoholáty za vzniku etherů (Williamsonova reakce, probíhá zahřívání): CH 3 Br + S 2 H 5 Ó Na → C2H5OCH3 + NaBr
methylbromid ethylát sodný methoxyethan,
Acylace - interakce s karboxylovými kyselinami a jejich deriváty za vzniku esterů (esterifikační reakce, probíhá za přítomnosti katalyzátoru):
CH 3 CO ON + S 2 H 5 ÓН ↔ СН 3 СООС 2 Н 5 + НОН
kyselina octová ethanol ethylacetát,
S karbonylovými sloučeninami - tvorba poloacetalů a acetalů:
ethanal methanol 1-methoxyethanol 1,2-dimethoxyethanol.
Alkoholáty jsou silnější báze a nukleofily než alkoholy.
c) substituční reakce hydroxylové skupiny (nukleofilní substituce - S N )
Často je v těchto reakcích OH skupina modifikována minerálními kyselinami nebo Lewisovými kyselinami (vznik oxoniových solí ROH 2 +). Modifikovaná hydroxylová skupina je snadno substituována atomem halogenu, aminoskupinou a alkoxyskupinou a dalšími skupinami. Reaktivita alkoholů se v těchto reakcích zvyšuje v tomto směru: primární< вторичные < третичные.
Příklady reakcí. Substituce hydroxylové skupiny za atom halogenu:
R- OH + TAK Cl 2 → R-Cl + НCl + SO 2
R- OH + R Hal 5 → R-Nal + Н-Нal + РОНal 3
R- OH + H- Hal→ R-Nal + NON
Reaktivita halogenovodíků roste směrem k НСl< НBr <НJ. Однако иодоводород практически не используют в реакциях этого типа, поскольку он легко восстанавливает спирты до углеводородов.
Substituce hydroxylové skupiny za amino a alkoxy skupiny:
R- OH + H - NH 2 → R-NH2 + NON
R- OH + RO- H → R-O-R + NON
Interakce s minerálními kyselinami za vzniku esterů:
R- OH + H -ÓNÓ 2 → R-ONO 2 + NON
alkylnitrát
R- OH + H -ÓSÓ 3 → R-OSO 3 + NON
alkylsulfát
Nukleofilní substituční reakce probíhají podle monomolekulárního (SN 1) nebo bimolekulárního (S N 2) mechanismu.
d) reakce eliminace hydroxylové skupiny (typ E, dehydratace alkoholů)
K eliminaci vody dochází při zahřívání v přítomnosti katalyzátoru – kyseliny sírové nebo fosforečné, oxidu zinku nebo hliníku. Dehydratace alkoholů s tvorbou alkenů probíhá v souladu se Zaitsevovým pravidlem: hydroxylová skupina se odštěpí z α-uhlíkového atomu, vodík z méně hydrogenovaného β-uhlíkového atomu alkoholu:
1-butanol 2-buten
Reaktivita alkoholů se zvyšuje v tomto směru: primární< вторичные < третичные.
Štěpné reakce probíhají podle monomolekulárního (E1) nebo bimolekulárního (E2) mechanismu.
e) oxidace alkoholů
Primární alkoholy jsou aktivnější v oxidačních reakcích, terciární alkoholy se za podobných podmínek neoxidují. Oxidační činidla: manganistan draselný nebo dichroman draselný v kyselém prostředí. Primární alkoholy se oxidují za vzniku aldehydů a poté - karboxylové kyseliny, sekundární alkoholy - ketony:
R-OH + [O] -> R-CH = O -> R-COOH
R2CH-OH + [O] -> R2C = O
Primární a sekundární alkoholy mohou být převedeny na karbonylové sloučeniny dehydrogenací. Reakce probíhají při 400-500 0 С v přítomnosti katalyzátoru Cu / Ag: