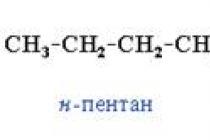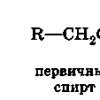कार्बनिक पदार्थों की प्रतिक्रियाओं को औपचारिक रूप से चार मुख्य प्रकारों में विभाजित किया जा सकता है: प्रतिस्थापन, जोड़, उन्मूलन (उन्मूलन), और पुनर्व्यवस्था (आइसोमेराइजेशन)। यह स्पष्ट है कि कार्बनिक यौगिकों की सभी प्रकार की प्रतिक्रियाओं को प्रस्तावित वर्गीकरण (उदाहरण के लिए, दहन प्रतिक्रियाओं) के ढांचे में नहीं लाया जा सकता है। हालांकि, इस तरह के वर्गीकरण से अकार्बनिक पदार्थों के बीच होने वाली प्रतिक्रियाओं के वर्गीकरण के साथ समानता स्थापित करने में मदद मिलेगी जो अकार्बनिक रसायन विज्ञान के पाठ्यक्रम से पहले से परिचित हैं।
एक नियम के रूप में, प्रतिक्रिया में भाग लेने वाले मुख्य कार्बनिक यौगिक को सब्सट्रेट कहा जाता है, और प्रतिक्रिया के अन्य घटक को पारंपरिक रूप से अभिकर्मक माना जाता है।
प्रतिस्थापन प्रतिक्रियाएं
जिन अभिक्रियाओं के परिणामस्वरूप मूल अणु (सब्सट्रेट) में एक परमाणु या परमाणुओं के समूह को अन्य परमाणुओं या परमाणुओं के समूहों के साथ प्रतिस्थापित किया जाता है, प्रतिस्थापन अभिक्रियाएँ कहलाती हैं।
संतृप्त और सुगंधित यौगिक, जैसे, उदाहरण के लिए, अल्केन्स, साइक्लोअल्केन्स या एरेन्स, प्रतिस्थापन प्रतिक्रियाओं में प्रवेश करते हैं।
आइए ऐसी प्रतिक्रियाओं के उदाहरण दें।
प्रकाश के प्रभाव में, मीथेन अणु में हाइड्रोजन परमाणुओं को हलोजन परमाणुओं द्वारा प्रतिस्थापित किया जा सकता है, उदाहरण के लिए, क्लोरीन परमाणु:
4 + Сl2 → СН3Сl + l
हाइड्रोजन को हैलोजन से बदलने का एक अन्य उदाहरण बेंजीन का ब्रोमोबेंजीन में रूपांतरण है:
रिकॉर्डिंग के इस रूप में, अभिकर्मकों, उत्प्रेरक और प्रतिक्रिया की स्थिति तीर के ऊपर दर्ज की जाती है, और अकार्बनिक प्रतिक्रिया उत्पाद - इसके नीचे।
जोड़ प्रतिक्रियाएं
वे अभिक्रियाएँ जिसके परिणामस्वरूप अभिकारकों के दो या दो से अधिक अणु एक साथ जुड़ते हैं, योगात्मक अभिक्रियाएँ कहलाती हैं।
असंतृप्त यौगिक, जैसे, उदाहरण के लिए, एल्केन्स या एल्काइन्स, अतिरिक्त प्रतिक्रिया में प्रवेश करते हैं। किस अणु के आधार पर अभिकर्मक के रूप में कार्य करता है, हाइड्रोजनीकरण (या कमी), हैलोजन, हाइड्रोहैलोजनीकरण, जलयोजन, और अन्य अतिरिक्त प्रतिक्रियाओं के बीच एक अंतर किया जाता है। उनमें से प्रत्येक को कुछ शर्तों की आवश्यकता होती है।
1 ... हाइड्रोजनीकरण - एक बहु बंधन में हाइड्रोजन अणु के जुड़ने की प्रतिक्रिया:
CH3-CH = CH2 + H2 → CH3-CH2-CH3
प्रोपेन प्रोपेन
2 ... हाइड्रोहलोजेनेशन - हाइड्रोजन हैलोजन जोड़ने की प्रतिक्रिया (उदाहरण के लिए, हाइड्रोक्लोरिनेशन):
CH2 = CH2 + HCl → CH3-CH2-Cl
एथीन क्लोरोइथेन
3 ... हैलोजनीकरण - हलोजन जोड़ प्रतिक्रिया (उदाहरण के लिए, क्लोरीनीकरण):
СН2 = СН2 + Сl2 → СН2Сl-СН2Сl
एथीन 1,2-डाइक्लोरोइथेन
4 ... बहुलकीकरण - एक विशेष प्रकार की जोड़ प्रतिक्रियाएं, जिसके दौरान कम आणविक भार वाले पदार्थ के अणु एक दूसरे के साथ मिलकर एक उच्च आणविक भार वाले पदार्थ के अणु बनाते हैं - मैक्रोमोलेक्यूल्स।
पॉलिमराइजेशन प्रतिक्रियाएं - ये एक कम आणविक भार पदार्थ (मोनोमर) के कई अणुओं को एक बहुलक के बड़े अणुओं (मैक्रोमोलेक्यूल्स) में संयोजित करने की प्रक्रिया है।
पोलीमराइज़ेशन प्रतिक्रिया का एक उदाहरण पराबैंगनी विकिरण की क्रिया के तहत एथिलीन (एथीन) से पॉलीइथाइलीन का उत्पादन और पोलीमराइज़ेशन आर के कट्टरपंथी सर्जक है।
कार्बनिक रसायन विज्ञान में रासायनिक प्रतिक्रियाओं के प्रकार
दरार (उन्मूलन) प्रतिक्रियाएं
जिन अभिक्रियाओं के परिणामस्वरूप मूल यौगिक के अणु से कई नए पदार्थों के अणु बनते हैं, उन्हें उन्मूलन या उन्मूलन अभिक्रियाएँ कहते हैं।
ऐसी प्रतिक्रियाओं के उदाहरण विभिन्न कार्बनिक पदार्थों से एथिलीन का उत्पादन हैं।

कार्बनिक रसायन विज्ञान में रासायनिक प्रतिक्रियाओं के प्रकार
दरार प्रतिक्रियाओं के बीच विशेष महत्व हाइड्रोकार्बन के थर्मल क्लेवाज की प्रतिक्रिया है, जिस पर अल्केन्स का क्रैकिंग (अंग्रेजी से क्रैक) आधारित है - सबसे महत्वपूर्ण तकनीकी प्रक्रिया:

ज्यादातर मामलों में, प्रारंभिक पदार्थ के अणु से एक छोटे अणु के टूटने से परमाणुओं के बीच एक अतिरिक्त n-आबंध का निर्माण होता है। कुछ शर्तों के तहत और कुछ अभिकर्मकों के साथ उन्मूलन प्रतिक्रियाएं आगे बढ़ती हैं। उपरोक्त समीकरण इन परिवर्तनों के केवल अंतिम परिणाम को दर्शाते हैं।
आइसोमेराइजेशन प्रतिक्रियाएं
वे अभिक्रियाएँ जिनके परिणामस्वरूप एक ही पदार्थ के अणु समान गुणात्मक और मात्रात्मक संरचना के अन्य पदार्थों के अणुओं से बनते हैं, अर्थात समान आणविक सूत्र के साथ, आइसोमेराइज़ेशन प्रतिक्रियाएँ कहलाती हैं।
इस तरह की प्रतिक्रिया का एक उदाहरण रैखिक अल्केन्स के कार्बन कंकाल का शाखित लोगों में आइसोमेराइजेशन है, जो उच्च तापमान पर एल्यूमीनियम क्लोराइड पर होता है:
कार्बनिक रसायन विज्ञान में रासायनिक प्रतिक्रियाओं के प्रकार
1 ... यह किस प्रकार की प्रतिक्रियाओं से संबंधित है:
क) मीथेन से क्लोरोमिथेन प्राप्त करना;
बी) बेंजीन से ब्रोमोबेंजीन प्राप्त करना;
ग) एथिलीन से क्लोरोइथेन प्राप्त करना;
घ) इथेनॉल से एथिलीन प्राप्त करना;
ई) ब्यूटेन का आइसोब्यूटेन में रूपांतरण;
च) ईथेन का निर्जलीकरण;
छ) ब्रोमोइथेन का इथेनॉल में रूपांतरण?
2 ... इसके लिए कौन सी प्रतिक्रियाएं विशिष्ट हैं: ए) अल्केन्स; बी) अल्केन्स? प्रतिक्रियाओं के उदाहरण दें।
3 ... आइसोमेराइजेशन प्रतिक्रियाओं की विशेषताएं क्या हैं? एक रासायनिक तत्व के एलोट्रोपिक संशोधन प्राप्त करने की प्रतिक्रियाओं के साथ उन्हें क्या एकजुट करता है? उदाहरण दो।
4. प्रारंभिक यौगिक का आणविक भार किन प्रतिक्रियाओं (जोड़, प्रतिस्थापन, उन्मूलन, आइसोमेराइजेशन) में है:
ए) बढ़ता है;
बी) घट जाती है;
ग) नहीं बदलता है;
d) क्या यह अभिकर्मक के आधार पर बढ़ता या घटता है?
न्युक्लेओफ़िलिकएक प्रतिक्रिया जिसमें एक अभिकर्मक अपने न्यूक्लियोफाइल के साथ एक सब्सट्रेट पर हमला करता है उसे कहा जाता है; यह सूचकांक द्वारा निरूपित किया जाता हैएन (न्यूक्लियोफिल)।
इलेक्ट्रोफिलिक प्रतिक्रियाओं में, अभिकर्मक को आमतौर पर इलेक्ट्रोफाइल कहा जाता है। कार्बनिक रसायन विज्ञान में, एक अभिकर्मक की इलेक्ट्रोफिलिसिटी सब्सट्रेट के कार्बन परमाणु के साथ बातचीत करने की क्षमता को दर्शाती है, जिसमें पूर्ण या आंशिक नकारात्मक चार्ज होता है।
वास्तव में, किसी भी इलेक्ट्रोफिलिक-न्यूक्लियोफिलिक प्रतिक्रिया का तंत्र और परिणाम न केवल अभिकर्मक के गुणों से निर्धारित होता है, बल्कि सब्सट्रेट के गुणों, परिणामी प्रतिक्रिया उत्पादों, विलायक और इसके कार्यान्वयन की शर्तों से भी निर्धारित होता है। इसलिए, अभिकर्मक के गुणों द्वारा केवल न्यूक्लियोफिलिक और इलेक्ट्रोफिलिक में इलेक्ट्रोफिलिक-न्यूक्लियोफिलिक प्रतिक्रियाओं का विभाजन सशर्त है। इसके अलावा, जैसा कि उपरोक्त योजनाओं से देखा जा सकता है, इन प्रतिक्रियाओं में, सब्सट्रेट और अभिकर्मक में निहित इलेक्ट्रोफाइल और न्यूक्लियोफाइल हमेशा एक दूसरे के साथ बातचीत करते हैं। कई प्रतिक्रियाओं में, केवल सशर्त रूप से एक घटक को एक सब्सट्रेट माना जा सकता है, और दूसरा - एक अभिकर्मक।
मुक्त कट्टरपंथी प्रतिक्रियाएं।होमोलिटिक क्षय एक गैर-ध्रुवीय या निम्न-ध्रुवीयता बंधन की विशेषता है। यह मुक्त कणों के निर्माण के साथ है - एक अप्रकाशित इलेक्ट्रॉन वाले कण।
एक सहसंयोजक बंधन के होमोलिसिस को विनिमय तंत्र द्वारा इस बंधन की दरार के रूप में माना जा सकता है। एक बंधन के होमोलिसिस को करने के लिए, ऊर्जा (गर्मी, प्रकाश) की आवश्यकता होती है, जो इस बंधन को तोड़ने के लिए पर्याप्त है। एक अयुग्मित इलेक्ट्रॉन की उपस्थिति मुक्त कणों की कम स्थिरता का कारण है (ज्यादातर मामलों में जीवनकाल एक सेकंड का अंश होता है) और उच्च प्रतिक्रियाशीलता मुक्त कट्टरपंथी प्रतिक्रियाएं।प्रणाली में एक मुक्त मूलक (R۰) की उपस्थिति मौजूदा अणुओं के साथ बातचीत के कारण नए कणों के गठन का कारण बन सकती है: R۰ + A - B → R - A + ۰B
मुक्त मूलक प्रतिक्रियाएंमुक्त कणों के अणुओं के साथ या आपस में नए मुक्त कणों (एक श्रृंखला के न्यूक्लियेशन या विकास) या केवल अणुओं (श्रृंखला समाप्ति) के गठन के साथ बातचीत के साथ।
मुक्त कट्टरपंथी प्रतिक्रियाओं को एक श्रृंखला तंत्र द्वारा विशेषता है जिसमें तीन चरण शामिल हैं: न्यूक्लिएशन, विकास और श्रृंखला समाप्ति। जब सिस्टम में फ्री रेडिकल्स गायब हो जाते हैं तो ये प्रतिक्रियाएं रुक जाती हैं। मुक्त मूलक अभिक्रियाओं को R सूचकांक द्वारा निर्दिष्ट किया जाता है (मौलिक)।
रेडिकल कण, उनके इलेक्ट्रॉन आत्मीयता के आधार पर, दोनों इलेक्ट्रॉनों को स्वीकार कर सकते हैं (यानी, ऑक्सीकरण एजेंट हो सकते हैं) और इलेक्ट्रॉनों को दान कर सकते हैं (यानी, एजेंट को कम कर सकते हैं)। इस मामले में, एक इलेक्ट्रॉन के लिए एक कट्टरपंथी की आत्मीयता न केवल उसके गुणों से निर्धारित होती है, बल्कि उसके प्रतिक्रिया साथी के गुणों से भी निर्धारित होती है। कार्बनिक यौगिकों के कुछ वर्गों के गुणों का वर्णन करते समय शरीर में होने वाली मुक्त मूलक ऑक्सीकरण-कमी की प्रक्रियाओं की विशेषताओं पर अलग से विचार किया जाता है।
जटिल प्रतिक्रियाओं में, एक जटिल एजेंट और लिगैंड दोनों कट्टरपंथी हो सकते हैं। चार्ज ट्रांसफर कॉम्प्लेक्स के मामले में, कॉम्प्लेक्सिंग एजेंट और लिगैंड के बीच इंट्रामोल्युलर ऑक्सीकरण-कमी के कारण कॉम्प्लेक्स के भीतर कट्टरपंथी गठन हो सकता है।
एक ही तत्व के परमाणुओं के बीच गैर-ध्रुवीय सरल बंधों के होमोलिसिस के दौरान सबसे आसानी से रेडिकल का निर्माण होता है:
C1 2 → C1۰ + ۰C1 HO-OH → HO۰ +
R-O-O-R "→ RO۰ + OR" R-S-S-R "→ RS۰ + SR"
निम्न-ध्रुवीयता C-H आबंध के होमोलिसिस के दौरान, ऐल्किल मूलक बनते हैं, जिसमें अयुग्मित इलेक्ट्रॉन कार्बन परमाणु पर स्थित होता है। इन मूलकों की आपेक्षिक स्थिरता अयुग्मित इलेक्ट्रॉन ले जाने वाले कार्बन परमाणु के प्रतिस्थापन के प्रकार पर निर्भर करती है, और श्रृंखला में बढ़ती है: सीएच 3< CH 2 R < CHR 2 < CR 3 . Это объясняется положительным индуктивным эффектом алкильных групп, который, повышая электронную плотность на атоме углерода, способствует стабилизации радикала.
मुक्त कणों की स्थिरता काफी बढ़ जाती है जब पड़ोसी कई बांडों के -इलेक्ट्रॉनों के कारण एक अयुग्मित इलेक्ट्रॉन के निरूपण की संभावना होती है। यह विशेष रूप से एलिल और बेंजाइल रेडिकल्स में स्पष्ट रूप से देखा गया है:
 |
एलिल रेडिकल बेंजाइल रेडिकल
सब्सट्रेट और अभिकर्मक अणुओं में संभावित प्रतिक्रिया तंत्र से परिचित होने के दौरान, किसी को उनकी प्रकृति से प्रतिक्रिया केंद्रों के बीच अंतर करना चाहिए: न्यूक्लियोफिलिक, इलेक्ट्रोफिलिकतथा मौलिक।
रासायनिक परिवर्तन के अंतिम परिणाम के अनुसार, सबसे सरल कार्बनिक प्रतिक्रियाओं को प्रतिक्रियाओं में वर्गीकृत किया जाता है: प्रतिस्थापन, जोड़, उन्मूलन (उन्मूलन)तथा पुनर्समूहन।
प्रतिस्थापन प्रतिक्रियाएं।प्रतिस्थापन से तात्पर्य किसी परमाणु या समूह का दूसरे परमाणु या समूह से प्रतिस्थापन करना है। प्रतिस्थापन अभिक्रिया में सदैव दो भिन्न उत्पाद बनते हैं। इस प्रकार की अभिक्रिया को प्रतीक S . द्वारा निरूपित किया जाता है (प्रतिस्थापन)।
प्रतिस्थापन प्रतिक्रियाओं में शामिल हैं: अल्केन्स का हैलोजन और नाइट्रेशन, कार्बोक्जिलिक एसिड का एस्टरीफिकेशन और अल्काइलेशन, साथ ही साथ ईथर, अल्कोहल और हैलोजन डेरिवेटिव के साथ सरल ध्रुवीय अणुओं (एच 2 ओ, एनएच 3, एनएचएल) की बातचीत की कई प्रतिक्रियाएं।
जोड़ प्रतिक्रियाएं।जोड़ को एक असंतृप्त यौगिक के अणु में परमाणुओं या समूहों की शुरूआत के रूप में समझा जाता है, साथ में -बंधों का टूटना। इस मामले में, डबल बॉन्ड साधारण में बदल जाते हैं, और ट्रिपल बॉन्ड - डबल या साधारण में। इस प्रकार की प्रतिक्रिया को प्रतीक A . द्वारा दर्शाया गया है (योग)।
उन्मूलन (दरार) प्रतिक्रियाएं।एलिमिनेशन का अर्थ है एक कार्बनिक अणु से परमाणुओं या समूहों का उन्मूलन एक बहु बंधन बनाने के लिए। इसलिए, उन्मूलन प्रतिक्रियाएं अतिरिक्त प्रतिक्रियाओं के विपरीत हैं। इस प्रकार की प्रतिक्रिया को प्रतीक E . द्वारा दर्शाया गया है (निकाल देना)।
कार्बनिक प्रतिस्थापन (एस), जोड़ (ए) या उन्मूलन (ई) प्रतिक्रियाओं में से प्रत्येक इलेक्ट्रोफिलिक (ई), न्यूक्लियोफिलिक (एन) या रेडिकल (आर) हो सकता है। इस प्रकार, कार्बनिक रसायन विज्ञान में, नौ विशिष्ट प्रतिक्रियाओं को प्रतिष्ठित किया जाता है, जिन्हें एस, ए या ई के साथ सूचकांक आर, एन या ई द्वारा दर्शाया जाता है:
इस प्रकार की कार्बनिक प्रतिक्रियाओं को आदर्श माना जाना चाहिए, क्योंकि उन्हें हमेशा शुद्ध रूप में महसूस नहीं किया जाता है। इसलिए, उदाहरण के लिए, प्रतिस्थापन और उन्मूलन एक साथ हो सकते हैं:
कार्बनिक यौगिकों के विशिष्ट वर्गों के साथ आगे परिचित होने पर, हम उनके निम्नलिखित रासायनिक गुणों पर विचार करेंगे: एसिड-बेस, कॉम्प्लेक्सिंग, रेडॉक्स, इलेक्ट्रोफिलिक-न्यूक्लियोफिलिक, साथ ही साथ रेडिकल इंटरैक्शन को मुक्त करने की क्षमता। जैविक प्रणालियों में विचाराधीन प्रतिक्रियाओं के पाठ्यक्रम की विशेषताओं पर विशेष ध्यान दिया जाएगा।
हाइड्रोकार्बन के विभिन्न वर्गों की अभिक्रियाओं के प्रकार, उनके पाठ्यक्रम की क्रियाविधि और प्रक्रियाओं के जैविक महत्व को तालिका 10 में प्रस्तुत किया गया है।
 |
कार्बनिक प्रतिक्रियाओं के वर्गीकरण के लिए विभिन्न प्रणालियाँ हैं, जो विभिन्न विशेषताओं पर आधारित हैं। उनमें से वर्गीकरण हैं:
- पर प्रतिक्रिया का अंतिम परिणाम, अर्थात्, सब्सट्रेट की संरचना में परिवर्तन;
- पर प्रतिक्रिया तंत्र, यानी बंधन तोड़ने के प्रकार और अभिकर्मकों के प्रकार से।
कार्बनिक प्रतिक्रिया में परस्पर क्रिया करने वाले पदार्थों को विभाजित किया जाता है अभिकर्मकतथा सब्सट्रेट... इस मामले में, अभिकर्मक को सब्सट्रेट पर हमला करने के लिए माना जाता है।
परिभाषा
अभिकर्मक- किसी वस्तु पर कार्य करने वाला पदार्थ - एक सब्सट्रेट - और उसमें रासायनिक बंधन में परिवर्तन का कारण बनता है। अभिकर्मकों को रेडिकल, इलेक्ट्रोफिलिक और न्यूक्लियोफिलिक के रूप में वर्गीकृत किया जाता है।
परिभाषा
सब्सट्रेटआमतौर पर एक अणु माना जाता है जो एक नए बंधन के लिए कार्बन परमाणु प्रदान करता है।
अंतिम परिणाम द्वारा प्रतिक्रियाओं का वर्गीकरण (सब्सट्रेट की संरचना में परिवर्तन)
कार्बनिक रसायन विज्ञान में, चार प्रकार की प्रतिक्रियाओं को अंतिम परिणाम और सब्सट्रेट की संरचना में परिवर्तन के अनुसार प्रतिष्ठित किया जाता है: इसके अलावा, प्रतिस्थापन, उन्मूलन,या निकाल देना(अंग्रेजी से। समाप्त करने के लिए- हटाएं, विभाजित करें), और पुनर्व्यवस्था (आइसोमेराइज़ेशन)) यह वर्गीकरण अकार्बनिक रसायन विज्ञान में प्रारंभिक अभिकर्मकों और परिणामी पदार्थों की संख्या के अनुसार, संरचना में परिवर्तन के साथ या बिना प्रतिक्रियाओं के वर्गीकरण के समान है। अंतिम परिणाम वर्गीकरण औपचारिक मानदंडों पर आधारित है, क्योंकि स्टोइकोमेट्रिक समीकरण, एक नियम के रूप में, प्रतिक्रिया तंत्र को प्रतिबिंबित नहीं करता है। आइए अकार्बनिक और कार्बनिक रसायन विज्ञान में प्रतिक्रियाओं के प्रकारों की तुलना करें।
अकार्बनिक रसायन विज्ञान में प्रतिक्रिया प्रकार | उदाहरण | कार्बनिक रसायन विज्ञान में प्रतिक्रिया प्रकार | विविधता और उदाहरण प्रतिक्रियाओं |
|---|---|---|---|
1. कनेक्शन | सी मैं2 + एच2 = 2 एच सी एल | एकाधिक लिंक द्वारा परिग्रहण | हाइड्रोजनीकरण |
हाइड्रोहलोजेनेशन
|
|||
हैलोजनीकरण
|
|||
हाइड्रेशन
|
|||
2. अपघटन | 2
एच2
ओ = 2 एच2
+
हे2
| निकाल देना | निर्जलीकरण
|
डीहाइड्रोहैलोजनेशन
|
|||
डीहलोजेनेशन
|
|||
निर्जलीकरण
|
|||
3. प्रतिस्थापन | जेड एन + 2 एच सी एल =ZnCl2 + H2 | प्रतिस्थापन |
|
4. एक्सचेंज (विशेष मामला - न्यूट्रलाइजेशन) | एच2 एस हे4 + 2 एन ए ओ एच= एन ए 2 एस ओ 4 + 2 एच 2 हे | विशेष मामला - एस्टरीफिकेशन |
|
5 आवंटन | सीसा ⇔ हीरा पीलाल⇔ पीसफेदपूर्व पी सफेद एससमचतुर्भुज⇔ एसपरत।श्रोम्ब।, स्पैस्ट। | आइसोमराइज़ेशन | आइसोमराइज़ेशन हाइड्रोकार्बन
|
ओ) उन्हें दूसरों के साथ बदले बिना।
जिसके आधार पर परमाणु अलग हो जाते हैं, पड़ोसी सी–सीया दो से तीन या अधिक कार्बन परमाणुओं द्वारा पृथक - सी-सी - सी- सी–, –सी-सी - सी - सी- सी-, यौगिकों के साथ एकाधिक बंधनऔर या चक्रीय यौगिक... ऐल्किल हैलाइड से हाइड्रोजन हैलाइड या ऐल्कोहॉल से जल का निष्कासन जैतसेव नियम के अनुसार होता है।
परिभाषा
जैतसेव का शासन: हाइड्रोजन परमाणु H सबसे कम हाइड्रोजनीकृत कार्बन परमाणु से अलग हो जाता है।
उदाहरण के लिए, क्षार की उपस्थिति में पड़ोसी परमाणुओं से हाइड्रोजन ब्रोमाइड अणु का उन्मूलन होता है, इस प्रकार सोडियम ब्रोमाइड और पानी बनता है।
परिभाषा
पुनर्वर्गीकरण- एक रासायनिक प्रतिक्रिया, जिसके परिणामस्वरूप एक अणु में परमाणुओं की पारस्परिक व्यवस्था में परिवर्तन होता है, कई बंधों की गति या उनकी बहुलता में परिवर्तन होता है।
अणु की परमाणु संरचना (आइसोमराइजेशन) के संरक्षण या इसके परिवर्तन के साथ पुनर्व्यवस्था की जा सकती है।
परिभाषा
आइसोमराइज़ेशन- पुनर्व्यवस्था प्रतिक्रिया का एक विशेष मामला, कार्बन कंकाल में संरचनात्मक परिवर्तनों द्वारा एक रासायनिक यौगिक के एक आइसोमर में परिवर्तन के लिए अग्रणी।
पुनर्व्यवस्था को होमोलिटिक या हेटेरोलाइटिक तंत्र द्वारा भी किया जा सकता है। आणविक पुनर्व्यवस्था को विभिन्न मानदंडों के अनुसार वर्गीकृत किया जा सकता है, उदाहरण के लिए, सिस्टम की संतृप्ति द्वारा, माइग्रेट करने वाले समूह की प्रकृति द्वारा, स्टीरियोस्पेसिफिकिटी द्वारा, आदि। कई पुनर्व्यवस्था प्रतिक्रियाओं के विशिष्ट नाम हैं - क्लेसेन पुनर्व्यवस्था, बेकमैन पुनर्व्यवस्था, आदि।
औद्योगिक प्रक्रियाओं में आइसोमेराइजेशन प्रतिक्रियाओं का व्यापक रूप से उपयोग किया जाता है, उदाहरण के लिए, पेट्रोल की ऑक्टेन संख्या बढ़ाने के लिए पेट्रोलियम शोधन में। आइसोमेरिज़ेशन का एक उदाहरण परिवर्तन है एन-ऑक्टेन से आइसोक्टेन:
अभिकर्मक प्रकार द्वारा कार्बनिक प्रतिक्रियाओं का वर्गीकरण
वियोग
कार्बनिक यौगिकों में बंधन दरार होमोलिटिक और हेटेरोलाइटिक हो सकते हैं। 
परिभाषा
होमोलिटिक बंधन टूटना- यह एक ऐसा गैप है, जिसके परिणामस्वरूप प्रत्येक परमाणु को एक अयुग्मित इलेक्ट्रॉन प्राप्त होता है और दो कण बनते हैं जिनकी इलेक्ट्रॉनिक संरचना समान होती है - मुक्त कण.
होमोलिटिक टूटना गैर-ध्रुवीय या थोड़ा ध्रुवीय की विशेषता हैबांड, उदाहरण के लिए सी - सी, सीएल - सीएल, सी - एच, और बहुत अधिक ऊर्जा की आवश्यकता होती है।
परिणामी रेडिकल, जिनमें एक अयुग्मित इलेक्ट्रॉन होता है, अत्यधिक प्रतिक्रियाशील होते हैं; इसलिए, ऐसे कणों से जुड़ी रासायनिक प्रक्रियाएं अक्सर प्रकृति में "श्रृंखला" होती हैं, जिन्हें नियंत्रित करना मुश्किल होता है, और प्रतिक्रिया के परिणामस्वरूप प्रतिस्थापन उत्पादों का एक सेट होता है। तो, मीथेन के क्लोरीनीकरण में, प्रतिस्थापन उत्पाद क्लोरोमेथेन होते हैं सी एच3 NS CH3Cl, डाइक्लोरोमीथेन सी एच2 सी मैं2 CH2Cl2, क्लोरोफॉर्म सी एच सी मैं3 सीएचसीएल3और कार्बन टेट्राक्लोराइड सी सी मैं4 सीसीएल4... मुक्त कणों से जुड़ी प्रतिक्रियाएं रासायनिक बंधों के निर्माण के विनिमय तंत्र द्वारा आगे बढ़ती हैं।
बंधन के इस तरह के दरार के दौरान बनने वाले रेडिकल का कारण बनता है कट्टरपंथी तंत्रप्रतिक्रिया का कोर्स। कट्टरपंथी प्रतिक्रियाएं आमतौर पर ऊंचे तापमान पर या विकिरण (जैसे प्रकाश) के साथ होती हैं।
उनकी उच्च प्रतिक्रियाशीलता के कारण, मुक्त कण मानव शरीर पर नकारात्मक प्रभाव डाल सकते हैं, कोशिका झिल्ली को नष्ट कर सकते हैं, डीएनए को प्रभावित कर सकते हैं और समय से पहले बूढ़ा हो सकते हैं। ये प्रक्रियाएं मुख्य रूप से लिपिड पेरोक्सीडेशन से जुड़ी होती हैं, यानी कोशिका झिल्ली के अंदर वसा बनाने वाले पॉलीअनसेचुरेटेड एसिड की संरचना का विनाश।
परिभाषा
हेटेरोलाइटिक वियोग- यह एक ऐसा अंतराल है जिसमें एक इलेक्ट्रॉन जोड़ी अधिक विद्युतीय परमाणु पर रहती है और दो आवेशित कण बनते हैं - आयन: एक धनायन (धनात्मक) और एक आयन (ऋणात्मक)।
रासायनिक अभिक्रियाओं में ये कण निम्नलिखित का कार्य करते हैं: नाभिकस्नेही"(" फिल "- जीआर से। प्यार करो) तथा " वैद्युतकणसंचलन", दाता-स्वीकर्ता तंत्र द्वारा प्रतिक्रिया में भागीदार के साथ रासायनिक बंधन बनाना। न्यूक्लियोफाइल कण एक नया बंधन बनाने के लिए एक इलेक्ट्रॉन जोड़ी प्रदान करते हैं। दूसरे शब्दों में,
परिभाषा
न्यूक्लियोफाइल- एक इलेक्ट्रॉन-समृद्ध रासायनिक अभिकर्मक जो इलेक्ट्रॉन-कमी वाले यौगिकों के साथ बातचीत करने में सक्षम है।
न्यूक्लियोफाइल के उदाहरण कोई भी आयन हैं ( सी मैं− , मैं− , एन हे− 3 क्ल−, मैं−, NO3−और अन्य), साथ ही साथ एक अकेला इलेक्ट्रॉन जोड़ी वाले यौगिक ( एन एच3 , एच2 हे NH3, H2O).
इस प्रकार, जब एक बंधन टूट जाता है, तो रेडिकल या न्यूक्लियोफाइल और इलेक्ट्रोफाइल बन सकते हैं। इसके आधार पर, कार्बनिक प्रतिक्रियाओं की घटना के लिए तीन तंत्र हैं।
कार्बनिक प्रतिक्रियाओं के तंत्र
मुक्त कट्टरपंथी तंत्र: प्रतिक्रिया की शुरुआत मुक्त रेडिकल द्वारा की जाती है जब होमोलिटिक गैपएक अणु में बंधन।
यूवी विकिरण के दौरान सबसे विशिष्ट प्रकार क्लोरीन या ब्रोमीन रेडिकल्स का निर्माण होता है।
1. मुक्त मूलक प्रतिस्थापन

मीथेन ब्रोमोमेथेन
चेन दीक्षा

श्रृंखला वृद्धि
खुला सर्किट
2. मुक्त कट्टरपंथी आसंजन
एथीन पॉलीथीन
इलेक्ट्रोफिलिक तंत्र: प्रतिक्रिया इलेक्ट्रोफाइल कणों द्वारा शुरू की जाती है, जिसके परिणामस्वरूप सकारात्मक चार्ज प्राप्त होता है हेटरोलाइटिक टूटनासंचार। सभी इलेक्ट्रोफाइल लुईस एसिड हैं।
इस तरह के कण सक्रिय रूप से की क्रिया के तहत बनते हैं लुईस एसिडजो कण के धनात्मक आवेश को बढ़ाते हैं। दूसरों की तुलना में अधिक बार उपयोग किया जाता है ए एल सी मैं3 , एफ ई सी मैं3 , फ़रवरी आर3 , जेड एन सी मैं2 AlCl3, FeCl3, FeBr3, ZnCl2उत्प्रेरक के रूप में कार्य कर रहा है।
एक इलेक्ट्रोफाइल कण के हमले का स्थान अणु के वे हिस्से होते हैं जिनमें इलेक्ट्रॉन घनत्व में वृद्धि होती है, यानी, एक बहु बंधन और एक बेंजीन रिंग।
इलेक्ट्रोफिलिक प्रतिस्थापन प्रतिक्रियाओं का सामान्य दृष्टिकोण समीकरण द्वारा व्यक्त किया जा सकता है:
1. इलेक्ट्रोफिलिक प्रतिस्थापन

बेंजीन ब्रोमोबेंजीन
2. इलेक्ट्रोफिलिक कनेक्शन
प्रोपेन 2-ब्रोमोप्रोपेन
प्रोपीन 1,2-डाइक्लोरोप्रोपीन
असममित असंतृप्त हाइड्रोकार्बन के साथ जुड़ना मार्कोवनिकोव नियम के अनुसार होता है।
परिभाषा
मार्कोवनिकोव का नियम:सशर्त सूत्र HX के साथ जटिल पदार्थों के अणुओं को असममित एल्केन्स (जहाँ X एक हैलोजन परमाणु या एक हाइड्रॉक्सिल समूह OH–) के साथ जोड़ना, एक हाइड्रोजन परमाणु सबसे अधिक हाइड्रोजनीकृत (सबसे अधिक हाइड्रोजन परमाणु युक्त) कार्बन परमाणु से जुड़ा होता है डबल बॉन्ड, और एक्स कम से कम हाइड्रोजनीकृत।
उदाहरण के लिए, हाइड्रोजन क्लोराइड एचसीएल को प्रोपेन अणु में जोड़ना सी एच3 - सी एच = सी एच2 सीएच3 - सीएच = सीएच2.

यह प्रतिक्रिया इलेक्ट्रोफिलिक जोड़ के तंत्र के अनुसार होती है। इलेक्ट्रॉन दाता प्रभाव के कारण सी एच3 सीएच3-समूह, सब्सट्रेट अणु में इलेक्ट्रॉन घनत्व केंद्रीय कार्बन परमाणु (आगमनात्मक प्रभाव) में स्थानांतरित हो जाता है, और फिर दोहरे बंधनों की प्रणाली के साथ - टर्मिनल कार्बन परमाणु में सी एच2 CH2-समूह (मेसोमेरिक प्रभाव)। इस प्रकार, अतिरिक्त ऋणात्मक आवेश इस परमाणु पर सटीक रूप से स्थानीयकृत होता है। इसलिए, हाइड्रोजन का प्रोटॉन हमला शुरू करता है एच+ एच +, जो एक इलेक्ट्रोफिलिक कण है। एक धनावेशित कार्बाइन आयन बनता है [सी एच3 - सी एच - सी एच3 ] + + जिससे क्लोरीन आयन जुड़ा होता है सी मैं− Cl-.
परिभाषा
मार्कोवनिकोव के शासन के अपवाद:अतिरिक्त प्रतिक्रिया मार्कोवनिकोव के नियम के खिलाफ आगे बढ़ती है यदि यौगिक जिसमें दोहरे बंधन के कार्बन परमाणु से सटे कार्बन परमाणु आंशिक रूप से इलेक्ट्रॉन घनत्व को वापस ले लेते हैं, अर्थात, एक महत्वपूर्ण इलेक्ट्रॉन-निकासी प्रभाव प्रदर्शित करने वाले पदार्थों की उपस्थिति में, प्रतिक्रिया दर्ज करें (- सी सी मैं3 , - सी एन, - सी ओ ओ एच(-CCl3, –CN, –COOHऔर आदि।)।

न्यूक्लियोफिलिक तंत्र: प्रतिक्रिया न्यूक्लियोफाइल कणों के साथ एक नकारात्मक चार्ज के साथ शुरू होती है, जिसके परिणामस्वरूप बनता है हेटरोलाइटिक टूटनासंचार। सभी न्यूक्लियोफाइल - लुईस संस्थापक.
न्यूक्लियोफिलिक प्रतिक्रियाओं में, अभिकर्मक (न्यूक्लियोफाइल) में परमाणुओं में से एक पर इलेक्ट्रॉनों की एक मुक्त जोड़ी होती है और एक तटस्थ अणु या आयन होता है ( एच ए मैं– , ओ एच– , आर हे− , आर एस– , आर सी ओ हे– , आर– , सी एन -, एच2 ओ, आर ओ एच, एन एच3 , आर एन एच2 हाल–, OH–, RO–, RS–, RCOO–, R–, CN–, H2O, ROH, NH3, RNH2और आदि।)।
न्यूक्लियोफाइल सबसे कम इलेक्ट्रॉन घनत्व (यानी, आंशिक या कुल सकारात्मक चार्ज के साथ) सब्सट्रेट में परमाणु पर हमला करता है। न्यूक्लियोफिलिक प्रतिस्थापन प्रतिक्रिया का पहला चरण कार्बोकेशन के गठन के साथ सब्सट्रेट का आयनीकरण है। इस मामले में, न्यूक्लियोफाइल के इलेक्ट्रॉन जोड़े के कारण एक नया बंधन बनता है, और पुराना एक हेटेरोलाइटिक दरार से गुजरता है, जिसके बाद केशन का उन्मूलन होता है। न्यूक्लियोफिलिक प्रतिक्रिया का एक उदाहरण न्यूक्लियोफिलिक प्रतिस्थापन है (प्रतीक एसएनएस.एन.) एक संतृप्त कार्बन परमाणु पर, उदाहरण के लिए, ब्रोमो डेरिवेटिव के क्षारीय हाइड्रोलिसिस।
1. न्यूक्लियोफिलिक प्रतिस्थापन
2. न्यूक्लियोफिलिक जोड़

एथनाल साइनोहाइड्रिन
स्रोत http://foxford.ru/wiki/himiya
प्रतिक्रिया के दौरान, कुछ रासायनिक बंधन प्रतिक्रिया करने वाले पदार्थों के अणुओं में टूट जाते हैं और अन्य बनते हैं। कार्बनिक प्रतिक्रियाओं को प्रतिक्रियाशील कणों में रासायनिक बंधनों के टूटने के प्रकार से वर्गीकृत किया जाता है। उनमें से, प्रतिक्रियाओं के दो बड़े समूहों को प्रतिष्ठित किया जा सकता है - कट्टरपंथी और आयनिक।
कट्टरपंथी प्रतिक्रियाएं सहसंयोजक बंधन के होमोलिटिक दरार से जुड़ी प्रक्रियाएं हैं। होमोलिटिक टूटना में, एक बंधन बनाने वाले इलेक्ट्रॉनों की एक जोड़ी को इस तरह से विभाजित किया जाता है कि परिणामी कणों में से प्रत्येक को एक इलेक्ट्रॉन प्राप्त होता है। होमोलिटिक टूटने के परिणामस्वरूप, मुक्त कण बनते हैं:
एक उदासीन परमाणु या अयुग्मित इलेक्ट्रॉन वाला कण मुक्त मूलक कहलाता है।
आयनिक प्रतिक्रियाएं ऐसी प्रक्रियाएं होती हैं जो सहसंयोजक बंधों के हेटेरोलाइटिक दरार के साथ होती हैं, जब दोनों बंधन इलेक्ट्रॉन पहले से बाध्य कणों में से एक के साथ रहते हैं:
हेटेरोलाइटिक बंधन दरार के परिणामस्वरूप, आवेशित कण प्राप्त होते हैं: न्यूक्लियोफिलिक और इलेक्ट्रोफिलिक।
एक न्यूक्लियोफिलिक कण (न्यूक्लियोफाइल) एक कण है जिसमें बाहरी इलेक्ट्रॉनिक स्तर पर इलेक्ट्रॉनों की एक जोड़ी होती है। इलेक्ट्रॉनों की एक जोड़ी के कारण, न्यूक्लियोफाइल एक नया सहसंयोजक बंधन बनाने में सक्षम है।
एक इलेक्ट्रोफिलिक कण (इलेक्ट्रोफाइल) एक कण है जिसमें एक अधूरा बाहरी इलेक्ट्रॉनिक स्तर होता है। इलेक्ट्रोफाइल कण के इलेक्ट्रॉनों के कारण सहसंयोजक बंधन के गठन के लिए खाली, खाली कक्षा का प्रतिनिधित्व करता है जिसके साथ यह बातचीत करता है।
कार्बनिक रसायन विज्ञान में, सभी संरचनात्मक परिवर्तनों को प्रतिक्रिया में शामिल कार्बन परमाणु (या परमाणुओं) के सापेक्ष माना जाता है।
उपरोक्त के अनुसार, प्रकाश के प्रभाव में मीथेन के क्लोरीनीकरण को कट्टरपंथी प्रतिस्थापन के रूप में वर्गीकृत किया जाता है, एल्केन्स में हैलोजन को जोड़ने को इलेक्ट्रोफिलिक जोड़ के रूप में वर्गीकृत किया जाता है, और एल्काइल हैलाइड्स के हाइड्रोलिसिस को न्यूक्लियोफिलिक प्रतिस्थापन के रूप में वर्गीकृत किया जाता है।
निम्नलिखित प्रकार के स्टॉक सबसे आम हैं।
रासायनिक प्रतिक्रियाओं के मुख्य प्रकार
मैं। प्रतिस्थापन प्रतिक्रियाएं(एक या एक से अधिक हाइड्रोजन परमाणुओं को हलोजन परमाणुओं या एक विशेष समूह के साथ बदलना) आरसीएच 2 एक्स + वाई → आरसीएच 2 वाई + एक्स
द्वितीय. जोड़ प्रतिक्रियाएं आरसीएच = सीएच 2 + एक्सवाई → आरसीएचएक्स - सीएच 2 वाई
III. दरार (उन्मूलन) प्रतिक्रियाएं आरसीएचएक्स - सीएच 2 वाई → आरसीएच = सीएच 2 + एक्सवाई
चतुर्थ। आइसोमेराइजेशन (पुनर्व्यवस्था) प्रतिक्रियाएं
वी ऑक्सीकरण प्रतिक्रियाएं(वायुमंडलीय ऑक्सीजन या ऑक्सीकरण एजेंट के साथ बातचीत)
इन उपरोक्त प्रकार की प्रतिक्रियाओं में, वे भेद भी करते हैं विशेषतथा दर्ज कराईप्रतिक्रियाएं।
विशिष्ट:
1) हाइड्रोजनीकरण (हाइड्रोजन के साथ अंतःक्रिया)
2) डिहाइड्रोजनीकरण (हाइड्रोजन अणु से उन्मूलन)
3) हैलोजन (हैलोजन के साथ अंतःक्रिया: F 2, Cl 2, Br 2, I 2)
4) डीहेलोजनेशन (एक हलोजन अणु से दरार)
5) हाइड्रोहैलोजनेशन (हाइड्रोजन हैलाइड के साथ अंतःक्रिया)
6) डिहाइड्रोहैलोजनेशन (हाइड्रोजन हैलाइड अणु से उन्मूलन)
7) जलयोजन (एक अपरिवर्तनीय प्रतिक्रिया में पानी के साथ बातचीत)
8) निर्जलीकरण (पानी के अणु से दरार)
9) हाइड्रोलिसिस (प्रतिवर्ती प्रतिक्रिया में पानी के साथ बातचीत)
10) पोलीमराइजेशन (एक ही साधारण यौगिकों से एक से अधिक बढ़े हुए कार्बन कंकाल प्राप्त करना)
11) पॉलीकंडेंसेशन (दो अलग-अलग यौगिकों से कई बढ़े हुए कार्बन कंकाल प्राप्त करना)
12) सल्फोनेशन (सल्फ्यूरिक एसिड के साथ बातचीत)
13) नाइट्रेशन (नाइट्रिक एसिड के साथ बातचीत)
14) क्रैकिंग (कार्बन कंकाल की कमी)
15) पायरोलिसिस (उच्च तापमान की क्रिया के तहत जटिल कार्बनिक पदार्थों का सरल में अपघटन)
16) क्षारीकरण प्रतिक्रिया (सूत्र में एक क्षारीय मूलक का परिचय)
17) एसाइलेशन प्रतिक्रिया (समूह -सी (सीएच 3) ओ का सूत्र में परिचय)
18) सुगंधीकरण प्रतिक्रिया (कई एरेन्स के हाइड्रोकार्बन का निर्माण)
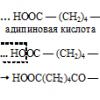
19) डीकार्बोक्सिलेशन प्रतिक्रिया (कार्बोक्सिल समूह के अणु से दरार -COOH)
20) एस्टरीफिकेशन रिएक्शन (एसिड के साथ अल्कोहल का इंटरेक्शन, या अल्कोहल या कार्बोक्जिलिक एसिड से एस्टर प्राप्त करना)
21) "चांदी के दर्पण" की प्रतिक्रिया (चांदी (आई) ऑक्साइड के अमोनिया समाधान के साथ बातचीत)
नाम प्रतिक्रियाएं:
1) वर्ट्ज़ प्रतिक्रिया (एक सक्रिय धातु के साथ हैलोजनयुक्त हाइड्रोकार्बन की बातचीत के दौरान कार्बन कंकाल का बढ़ाव)
2) कुचेरोव की प्रतिक्रिया (पानी के साथ एसिटिलीन की प्रतिक्रिया से एल्डिहाइड प्राप्त करना)
3) कोनोवलोव प्रतिक्रिया (पतले नाइट्रिक एसिड के साथ एक अल्केन की बातचीत)
4) वैगनर प्रतिक्रिया (सामान्य परिस्थितियों में कमजोर क्षारीय या तटस्थ माध्यम में ऑक्सीकरण एजेंट के ऑक्सीजन द्वारा दोहरे बंधन के साथ हाइड्रोकार्बन का ऑक्सीकरण)
5) लेबेदेव प्रतिक्रिया (एल्केडिएन्स की तैयारी में अल्कोहल का निर्जलीकरण और निर्जलीकरण)
6) फ्राइडल-शिल्प प्रतिक्रिया (बेंजीन होमोलॉग प्राप्त करने के लिए क्लोरोएल्केन के साथ एरेन एल्केलाइज़ेशन की प्रतिक्रिया)
7) ज़ेलिंस्की प्रतिक्रिया (डिहाइड्रोजनीकरण द्वारा साइक्लोहेक्सेन से बेंजीन प्राप्त करना)
8) किरचॉफ प्रतिक्रिया (सल्फ्यूरिक एसिड की उत्प्रेरक क्रिया के दौरान स्टार्च का ग्लूकोज में रूपांतरण)