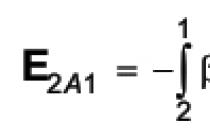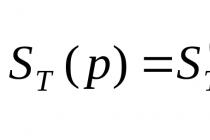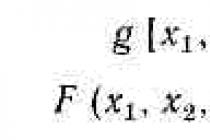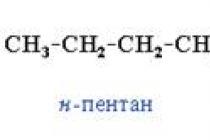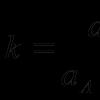शिक्षा के लिए संघीय एजेंसी
अंगार्स्क राज्य तकनीकी अकादमी
रसायनिकी विभाग
कोर्स वर्क
अनुशासन "रसायन विज्ञान" में
थीम:
थर्मोडायनामिक क्षमता का निर्धारण
प्रतिक्रिया में रासायनिक प्रक्रियाओं का क्रम:
निष्पादक: *********.
समूह छात्र ईयूपी-08-10
पर्यवेक्षक:
रसायन विज्ञान विभाग के एसोसिएट प्रोफेसर
टीए कुज़नेत्सोवा
अंगार्स्क 2009
टर्म पेपर के लिए असाइनमेंट
1. प्रतिक्रिया में सभी प्रतिभागियों की भौतिक-रासायनिक विशेषताओं और उनकी तैयारी के तरीकों को प्रदान करें।
4. प्रतिक्रिया की संभावना निर्धारित करें एच 2+ NS 2=2 एचसीएलमानक परिस्थितियों में और तापमान पर = 1000 के.
5. Temkin-Shvartsman पद्धति का उपयोग करके, गणना करें
तापमान पर = 1200, = 1500। निर्भरता की साजिश रचकर, उस तापमान को ग्राफिक रूप से निर्धारित करें जिस पर प्रक्रिया आगे की दिशा में सहज के रूप में संभव है। = 1200, = 1500।
1. सैद्धांतिक भाग
1.1 इथेनॉल और इसके गुण
इथेनॉल - एक रंगहीन मोबाइल तरल जिसमें एक विशिष्ट गंध और तीखा स्वाद होता है।
तालिका 1. इथेनॉल के भौतिक गुण
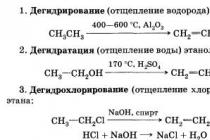
पानी, ईथर, एसीटोन और कई अन्य कार्बनिक सॉल्वैंट्स के साथ गलत; ज्वलनशील; इथेनॉल हवा के साथ विस्फोटक मिश्रण बनाता है (मात्रा के हिसाब से 3.28-18.95%)। इथेनॉल में मोनोहाइड्रिक अल्कोहल के सभी रासायनिक गुण होते हैं, उदाहरण के लिए, यह क्षार और क्षारीय पृथ्वी धातुओं के साथ अल्कोहल बनाता है, एसिड के साथ एस्टर, इथेनॉल ऑक्सीकरण के दौरान एसिटालडिहाइड, और निर्जलीकरण के दौरान एथिलीन और एथिल ईथर। इथेनॉल के क्लोरीनीकरण से क्लोरल बनता है।
1.2 इथेनॉल के उत्पादन के लिए तरीके
इथेनॉल प्राप्त करने के 2 मुख्य तरीके हैं - सूक्ष्मजीवविज्ञानी ( किण्वनतथा हाइड्रोलिसिस) और सिंथेटिक:
किण्वन
इथेनॉल के उत्पादन की विधि, जिसे लंबे समय से जाना जाता है, चीनी (बीट्स, आदि) युक्त कार्बनिक उत्पादों का अल्कोहलिक किण्वन है। स्टार्च, आलू, चावल, मक्का, लकड़ी आदि का ज़ाइमेज़ एंजाइम की क्रिया के तहत प्रसंस्करण समान दिखता है। यह प्रतिक्रिया बल्कि जटिल है, इसकी योजना समीकरण द्वारा व्यक्त की जा सकती है:
सी 6 एच 12 ओ 6 → 2सी 2 एच 5 ओएच + 2सीओ 2
किण्वन के परिणामस्वरूप, एक समाधान प्राप्त होता है जिसमें 15% से अधिक इथेनॉल नहीं होता है, क्योंकि अधिक केंद्रित समाधानों में खमीर आमतौर पर मर जाता है। इस प्रकार प्राप्त इथेनॉल को आमतौर पर आसवन द्वारा शुद्ध और केंद्रित करने की आवश्यकता होती है।
जैविक कच्चे माल से शराब का औद्योगिक उत्पादन
डिस्टिलरीज
हाइड्रोलिसिस उत्पादन
हाइड्रोलिसिस उत्पादन के लिए, सेल्यूलोज युक्त कच्चे माल का उपयोग किया जाता है - लकड़ी, पुआल।
किण्वन उत्पादन से अपशिष्ट स्थिर और फ़्यूज़ल तेल है
एथिलीन जलयोजन
उद्योग में, पहली विधि के साथ, एथिलीन जलयोजन का उपयोग किया जाता है। हाइड्रेशन दो तरह से किया जा सकता है:
300 डिग्री सेल्सियस के तापमान पर प्रत्यक्ष जलयोजन, 7 एमपीए का दबाव, सिलिका जेल पर लागू ऑर्थोफॉस्फोरिक एसिड, सक्रिय कार्बन या एस्बेस्टस उत्प्रेरक के रूप में उपयोग किया जाता है:
सीएच 2 = सीएच 2 + एच 2 ओ → सी 2 एच 5 ओएच
एक मध्यवर्ती सल्फ्यूरिक एसिड एस्टर के चरण के माध्यम से हाइड्रेशन, इसके हाइड्रोलिसिस के बाद (80-90 डिग्री सेल्सियस के तापमान पर और 3.5 एमपीए का दबाव):
सीएच 2 = सीएच 2 + एच 2 एसओ 4 → सीएच 3 -सीएच 2 -ओएसओ 2 ओएच (एथिल सल्फ्यूरिक एसिड)
सीएच 3 -सीएच 2 -ओएसओ 2 ओएच + एच 2 ओ → सी 2 एच 5 ओएच + एच 2 एसओ 4
डायथाइल ईथर के निर्माण से यह प्रतिक्रिया जटिल है।
इथेनॉल शुद्धि
एथेनॉल, एथिलीन के जलयोजन या किण्वन द्वारा प्राप्त किया जाता है, एक जल-अल्कोहल मिश्रण होता है जिसमें अशुद्धियाँ होती हैं। इसके औद्योगिक, खाद्य और औषधीय उपयोग के लिए शुद्धिकरण की आवश्यकता होती है। आंशिक आसवन मात्रा से लगभग 95.6% की एकाग्रता के साथ इथेनॉल प्राप्त करने की अनुमति देता है; इस अविभाज्य एज़ोट्रोपिक मिश्रण में 4.4% पानी (wt.) होता है और इसका क्वथनांक 78.2 ° C होता है।
आसवन इथेनॉल को कार्बनिक पदार्थों (अभी भी नीचे) के अत्यधिक अस्थिर और भारी अंशों दोनों से मुक्त करता है।
पूर्ण शराब
निरपेक्ष अल्कोहल एथिल अल्कोहल है जिसमें वस्तुतः पानी नहीं होता है। 78.39 डिग्री सेल्सियस पर उबालने पर कम से कम 4.43% पानी युक्त रेक्टिफाइड अल्कोहल 78.15 डिग्री सेल्सियस पर उबलता है। बेंजीन और अन्य विधियों से युक्त जलीय अल्कोहल के आसवन द्वारा प्राप्त किया जाता है।
1.3 आवेदन
ईंधन
इथेनॉल का उपयोग ईंधन के रूप में किया जा सकता है (रॉकेट इंजन, आंतरिक दहन इंजन सहित)।
रसायन उद्योग
एसीटैल्डिहाइड, डायथाइल ईथर, टेट्राएथिल लेड, एसिटिक एसिड, क्लोरोफॉर्म, एथिल एसीटेट, एथिलीन, आदि जैसे कई रसायनों के उत्पादन के लिए कच्चे माल के रूप में कार्य करता है;
· यह व्यापक रूप से विलायक के रूप में उपयोग किया जाता है (पेंट उद्योग में, घरेलू रसायनों और कई अन्य क्षेत्रों के उत्पादन में);
· एंटीफ्ीज़र का एक घटक है।
दवा
एथिल अल्कोहल मुख्य रूप से एक एंटीसेप्टिक के रूप में प्रयोग किया जाता है
बाहरी रूप से कीटाणुनाशक और सुखाने वाले एजेंट के रूप में;
दवाओं के लिए एक विलायक, टिंचर की तैयारी के लिए, पौधों की सामग्री से अर्क, आदि;
टिंचर और अर्क के लिए परिरक्षक (न्यूनतम एकाग्रता 18%)
इत्र और सौंदर्य प्रसाधन
यह विभिन्न सुगंधित पदार्थों और इत्र, कोलोन आदि के मुख्य घटक के लिए एक सार्वभौमिक विलायक है। यह विभिन्न प्रकार के लोशन का हिस्सा है।
खाद्य उद्योग
पानी के साथ, यह मादक पेय (वोदका, व्हिस्की, जिन, आदि) का एक आवश्यक घटक है। यह कई किण्वित पेय पदार्थों में भी कम मात्रा में निहित होता है जिन्हें मादक (केफिर, क्वास, कुमिस, गैर-मादक बीयर, आदि) के रूप में वर्गीकृत नहीं किया जाता है। ताजा केफिर में इथेनॉल की मात्रा नगण्य (0.12%) होती है, लेकिन लंबे समय तक, विशेष रूप से गर्म स्थान पर, यह 1% तक पहुंच सकती है। कुमिस में 1-3% इथेनॉल (4.5% तक मजबूत), क्वास में - 0.6 से 2.2% तक होता है। भोजन के स्वाद के लिए विलायक। इसका उपयोग बेकरी उत्पादों के साथ-साथ कन्फेक्शनरी उद्योग में परिरक्षक के रूप में किया जाता है
1.4 एथिलीन। भौतिक और रासायनिक गुण
ईथीलीन, H2C = CH2 - असंतृप्त हाइड्रोकार्बन, ओलेफिन की समजातीय श्रृंखला का पहला सदस्य, एक कमजोर ईथर गंध वाली रंगहीन गैस; पानी में व्यावहारिक रूप से अघुलनशील, खराब - शराब में, बेहतर - ईथर, एसीटोन में। यह कम-धूम्रपान वाली लौ से जलता है, हवा के साथ विस्फोटक मिश्रण बनाता है। एथिलीन अत्यधिक प्रतिक्रियाशील है।
तालिका 2. एथिलीन के भौतिक गुण
एक सहज प्रतिक्रिया की संभावना;
एन्ट्रॉपी;
आइसोबैरिक - इज़ोटेर्मल क्षमता या गिब्स मुक्त ऊर्जा।
तत्क्षणप्रक्रियाओं को कहा जाता है, जिसके परिणामस्वरूप उपयोगी कार्य प्राप्त किया जा सकता है, गैर सहजवे प्रक्रियाएँ जिनके लिए कार्य को व्यय करने की आवश्यकता होती है, कहलाती हैं।
दो स्वतःस्फूर्त प्रक्रियाओं पर विचार करें - सोडियम हाइड्रॉक्साइड का विघटन और अमोनियम नाइट्रेट का विघटन:
ये स्वतःस्फूर्त प्रक्रियाएं हैं, लेकिन उनमें से एक गर्मी की रिहाई के साथ है, और दूसरी गर्मी के अवशोषण के साथ है। जैसा कि आप देख सकते हैं, प्रक्रिया (थैलेपी कारक) के गर्मी प्रभाव का संकेत सहज प्रक्रिया प्रवाह की संभावना को स्पष्ट रूप से निर्धारित नहीं करता है। प्रक्रिया की सहजता में एक दूसरा कारक है - एन्ट्रापी कारक.
एन्ट्रापी क्या है?
किसी भी प्रणाली की स्थिति का वर्णन किया जा सकता है, एक तरफ, सिस्टम के मापा मापदंडों (सिस्टम के मैक्रोस्टेट्स) के मूल्य से, दूसरी ओर, सिस्टम की स्थिति को तत्काल माइक्रोस्टेट्स के एक सेट द्वारा वर्णित किया जा सकता है , जो हमारे सिस्टम को बनाने वाले माइक्रोपार्टिकल्स के विभिन्न ऊर्जा स्तरों के अनुरूप हैं।
किसी पदार्थ के दिए गए मैक्रोस्टेट से मेल खाने वाले माइक्रोस्टेट्स की संख्या कहलाती है थर्मोडायनामिक संभावनाइसकी अवस्थाएँ (W), अर्थात्, W उन तरीकों की संख्या है जिनसे अणुओं को विभिन्न ऊर्जा स्तरों पर वितरित किया जा सकता है।
एक राज्य की थर्मोडायनामिक संभावना सिस्टम की स्थिति के एक फ़ंक्शन से जुड़ी होती है जिसे एन्ट्रॉपी (एस) कहा जाता है।
एस = के एलएन डब्ल्यू, जहां के बोल्ट्जमान स्थिरांक है, के 1.38 ∙ 10 -23 जे / के,
डब्ल्यू सिस्टम की स्थिति की थर्मोडायनामिक संभावना है।
किसी पदार्थ के 1 मोल के लिए:
एस = आर एलएन डब्ल्यू, जहां आर सार्वभौमिक गैस स्थिरांक है, यहां एस को मापा जाता है।
स्थिति संभावना ज्यादा से ज्यादाप्रणाली के अधिकतम विकार पर, यानी, जब सिस्टम सबसे अधिक अव्यवस्थित अवस्था में होता है, तो एन्ट्रापी अधिकतम होती है। यह वही है जो सिस्टम अनायास प्रयास करता है।
कोई भी प्रणाली सबसे बड़े विकार की स्थिति में चली जाती है, यानी अनायास ही, कोई भी प्रणाली एन्ट्रापी को बढ़ा देती है। तथा एन्ट्रापी व्यवस्था में गड़बड़ी का पैमाना है। यह पिघलने, उबलने, गैसों के विस्तार जैसी भौतिक प्रक्रियाओं में बढ़ता है। रासायनिक प्रक्रियाओं में, एन्ट्रापी बढ़ जाती है यदि गैसीय प्रतिक्रिया उत्पाद ठोस या तरल अवस्था में लिए गए प्रारंभिक पदार्थों से प्राप्त होते हैं, या यदि प्रतिक्रिया के दौरान अणुओं की संख्या बढ़ जाती है।
यानी एन्ट्रापी बढ़ती है, क्योंकि गतिमान कणों की संख्या बढ़ जाती है।
डी एस< 0 , - энтропия уменьшается т. к. уменьшается количество частиц (из 3-х в 2) и система переходит из газообразного состояния в жидкое.
आइए हम एक राज्य से संक्रमण के दौरान सिस्टम में एन्ट्रापी में बदलाव पर विचार करें, जो कि वॉल्यूम वी 1 से दूसरे में - वॉल्यूम वी 2 के साथ होता है:
अगर वी 2> वी 1, फिर डीएस> 0, अगर वी 2< V 1 , то DS < 0, т.е. при увеличении объема энтропия увеличивается.
निरपेक्ष शून्य पर एक आदर्श क्रिस्टल की एन्ट्रापी शून्य होती है, इसलिए आप प्रत्येक पदार्थ के लिए एन्ट्रापी के निरपेक्ष मान की गणना कर सकते हैं। तालिकाएँ मानक परिस्थितियों में मानक एन्ट्रापी मान (S °) दिखाती हैं।
एन्ट्रापी- पदार्थ की स्थिति का कार्य, इसलिए, प्रणाली के एक राज्य से दूसरे राज्य में संक्रमण के पथ पर निर्भर नहीं करता है। प्रतिवर्ती इज़ोटेर्मल प्रक्रियाओं के लिए ( चरण संक्रमण), एन्ट्रापी में परिवर्तन तापमान से विभाजित थैलीपी में परिवर्तन के बराबर है:
एन्ट्रापी तापमान पर निर्भर करती है:
जहां - निरंतर दबाव पर दाढ़ ताप क्षमता।
मुख्य रूप से अणुओं की आंतरिक संरचना से जुड़ी संपत्ति के रूप में पदार्थों की थैलीपी व्यावहारिक रूप से दबाव से स्वतंत्र होती है, जो आमतौर पर इंट्रामोल्युलर इंटरैक्शन से हमेशा बहुत कम होती है। अपवाद अल्ट्राहाई दबावों पर की जाने वाली प्रक्रियाएं हैं, उदाहरण के लिए, हीरे के संश्लेषण के दौरान। फिर दबाव पर थैलेपी की निर्भरता को ध्यान में रखना आवश्यक है।
ठोस और तरल पिंड, जो मजबूत अंतर-आणविक अंतःक्रिया के कारण संघनित अवस्था में होते हैं, उचित दबावों पर व्यावहारिक रूप से असम्पीडित होते हैं। इसलिए, सदस्य आरडी वीसंघनित निकायों के लिए थर्मोडायनामिक मात्रा में आमतौर पर छोटा होता है। इससे यह होगा ठोस और तरल पदार्थ के लिएस्थिर दाब पर ऊष्मा तथा आंतरिक ऊर्जा तथा एन्थैल्पी के आयतन के बीच कोई अंतर नहीं किया जा सकता है
व्यावहारिक असंगति के कारण, यह माना जा सकता है कि संघनित निकायों की एन्ट्रापी एस या तो दबाव पर निर्भर नहीं करती है: बहुत कम अतिरिक्त ऊर्जा दबाव के माध्यम से अंदर स्थानांतरित की जाती है ( आरडी वी), इंट्रामोल्युलर और इंटरमॉलिक्युलर इंटरैक्शन के कारण पहले से मौजूद शरीर की तुलना में।
परंतु गैसों के लिए, जहां अंतर-आणविक संपर्क बहुत छोटा है , एन्ट्रापी प्रणाली के दबाव और आयतन पर महत्वपूर्ण रूप से निर्भर करती है। दरअसल, प्रारंभिक मूल्य से इज़ोटेर्मल दबाव परिवर्तन की प्रक्रिया पर विचार करें आर 0 से कुछ आरमात्रा में एक साथ परिवर्तन के साथ। फिर, एक आदर्श गैस के लिए राज्य के समीकरण का उपयोग करते हुए, शरीर पर किए गए कार्य के लिए ( पीवी = आरटी) हम पाते हैं:
चूंकि एक इज़ोटेर्मल प्रक्रिया पर विचार किया जाता है, आंतरिक ऊर्जा में परिवर्तन यूसिस्टम में नहीं होता है: जारी या अवशोषित गर्मी पर्यावरण से दी या प्राप्त की जाएगी, जो आंतरिक ऊर्जा में अस्थायी परिवर्तन की भरपाई करेगी। इसलिए, प्राप्त कार्य और ऊष्मा का योग शून्य है:
टी.ई. प्रारंभिक से भिन्न दाब पर गैस की एन्ट्रापी का निरपेक्ष मान है:
 (1.32)
(1.32)
रासायनिक प्रतिक्रिया का ऊष्मा प्रभाव
प्रतिक्रिया के गर्मी प्रभाव की गणना के लिए प्रारंभिक डेटा
 (1.33)
(1.33)
गठन की गर्मी हैं (  मैंप्रतिक्रिया में भाग लेने वाले पदार्थ:
मैंप्रतिक्रिया में भाग लेने वाले पदार्थ:
 (1.34)
(1.34)
यदि, माना तापमान सीमा के भीतर, एक या एक से अधिक प्रतिक्रिया घटक चरण परिवर्तन से गुजरते हैं, तो तापमान सीमा को कई भागों में विभाजित किया जाता है:
परिवर्तन की गर्मी एचप्रतिक्रिया उत्पादों या प्रारंभिक सामग्री से संबंधित के आधार पर पीआर को अपने या विपरीत संकेत के साथ लिया जाता है।
तापमान पर प्रतिक्रिया की एन्ट्रापी टीसूत्र द्वारा गणना
 (1.36)
(1.36)

चरण संक्रमण की उपस्थिति में, एकीकरण अंतराल को अलग-अलग वर्गों में विभाजित किया गया है:
यह मानते हुए कि गर्मी क्षमता को फॉर्म के बहुपद द्वारा वर्णित किया गया है  आप इसे प्राप्त कर सकते हैं
आप इसे प्राप्त कर सकते हैं

प्रतिक्रिया की थर्मोडायनामिक संभावना का आकलन
रासायनिक प्रतिक्रिया की विशिष्ट स्थितियों के लिए ( टी= स्थिरांक, आर= कास्ट) प्रतिक्रिया की थर्मोडायनामिक संभावना गिब्स ऊर्जा के मूल्य में परिवर्तन के संकेत से निर्धारित होती है जीप्रतिक्रिया के दौरान प्रणाली यह प्रतिक्रिया तब होती है जब जी< 0.
पदार्थों के थर्मोडायनामिक गुणों से डेटा (गठन की मानक गर्मी (एंथैल्पी), गर्मी क्षमता एन्ट्रॉपी, या संदर्भ पुस्तकों में दी गई कम क्षमता का उपयोग करके, कोई आसानी से मानक गिब्स क्षमता में परिवर्तन की गणना कर सकता है, जब प्रारंभिक स्थिति को माना जाता है हो कि सभी प्रारंभिक दबाव 1 atm . के बराबर हों
 . (1.40)
. (1.40)
सिद्धांत रूप में, इस विशेषता का उपयोग किसी प्रतिक्रिया की थर्मोडायनामिक संभावना का अनुमान लगाने के लिए किया जा सकता है। हालांकि, इस तरह के आकलन को सावधानी के साथ किया जाना चाहिए, क्योंकि वास्तविक प्रणालियों में प्रारंभिक दबाव शायद ही कभी 1 एटीएम के बराबर होता है।
बिल्कुल विश्वसनीय मनमानी प्रारंभिक स्थितियों के तहत प्रतिक्रिया की संभावना की विशेषता मानक क्षमता में परिवर्तन के साथ जुड़े गिब्स क्षमता में सही परिवर्तन है रासायनिक प्रतिक्रिया इज़ोटेर्म समीकरण:

कहां क पी – प्रतिक्रिया का संतुलन स्थिरांक, और आंशिक दबाव पी" मैं प्रतिक्रिया उत्पादों का संदर्भ लें, और पी मैं - अभिकर्मकों के लिए।
सामान्य तौर पर, संकेत  संकेत से मेल नहीं खा सकता
संकेत से मेल नहीं खा सकता  .
.
मानक गिब्स ऊर्जा में परिवर्तन का सकारात्मक मूल्य प्रतिक्रिया की पूर्ण असंभवता को इंगित नहीं करता है, लेकिन मानक राज्य में उत्पादों की केवल एक महत्वहीन या बहुत कम उपज है। इज़ोटेर्म समीकरण के दायीं ओर दूसरे पद की उपस्थिति इंगित करती है कि मानक गिब्स ऊर्जा में परिवर्तन के सकारात्मक मूल्यों के साथ भी उत्पादों की एक महत्वपूर्ण उपज प्राप्त की जा सकती है। यह प्रतिक्रिया प्रतिभागियों के दबावों के बीच एक निश्चित अनुपात की प्रणाली में निर्माण के कारण होगा।
थर्मोडायनामिक क्षमता प्रतिक्रिया के पाठ्यक्रम को इसके से अलग किया जाना चाहिए व्यावहारिक संभावनाएं , जिसका अर्थ है एक प्रशंसनीय दर के साथ प्रतिक्रिया की प्रगति। गतिज बाधाओं की उपस्थिति आवश्यक गति से प्रतिक्रिया करने में बाधा बन सकती है। इस प्रकार, प्रतिक्रिया की थर्मोडायनामिक संभावना का अर्थ केवल प्रतिक्रिया की मौलिक व्यवहार्यता, विचाराधीन शर्तों के तहत इसकी सहज घटना की संभावना है, लेकिन उत्पादों में प्रारंभिक पदार्थों के परिवर्तन की अंतिम दर की गारंटी नहीं देता है।
रासायनिक ऊष्मप्रवैगिकी प्रतिक्रियाओं के ऊर्जा प्रभावों, उनकी दिशा और सहज प्रवाह की सीमाओं का अध्ययन करती है।
रासायनिक ऊष्मप्रवैगिकी में अध्ययन का उद्देश्य - एक थर्मोडायनामिक प्रणाली (इसके बाद बस एक प्रणाली) - पर्यावरण से मानसिक रूप से या वास्तव में अलग-अलग परस्पर क्रिया करने वाले पदार्थों का एक समूह है।
प्रणाली विभिन्न राज्यों में हो सकती है। सिस्टम की स्थिति थर्मोडायनामिक मापदंडों के संख्यात्मक मूल्यों द्वारा निर्धारित की जाती है:तापमान, दबाव, पदार्थों की एकाग्रता, आदि। जब थर्मोडायनामिक मापदंडों में से कम से कम एक का मूल्य, उदाहरण के लिए, तापमान, परिवर्तन, सिस्टम की स्थिति बदल जाती है। एक प्रणाली की स्थिति में परिवर्तन को थर्मोडायनामिक प्रक्रिया या केवल एक प्रक्रिया कहा जाता है।
प्रक्रियाएं विभिन्न गति से चल सकती हैं। एक राज्य से दूसरे राज्य में एक प्रणाली के संक्रमण के लिए शर्तों के आधार पर, रासायनिक थर्मोडायनामिक्स में कई प्रकार की प्रक्रियाओं को प्रतिष्ठित किया जाता है, जिनमें से सबसे सरल इज़ोटेर्मल हैं, एक स्थिर तापमान (टी = कॉन्स) पर आगे बढ़ते हुए, आइसोबैरिक, निरंतर दबाव में आगे बढ़ना (पी = कास्ट), आइसोकोरिक, एक स्थिर मात्रा (वी = कॉन्स्ट) और एडियाबेटिक पर बहता है, जो सिस्टम और पर्यावरण (क्यू = कॉन्स्ट) के बीच गर्मी विनिमय के बिना किया जाता है। अक्सर रासायनिक थर्मोडायनामिक्स में, प्रतिक्रियाओं को आइसोबैरिक-आइसोथर्मल (पी = कॉन्स, टी = कॉन्स्ट) या आइसोकोरिक-इज़ोटेर्मल (वी = कॉन्स्ट, टी = कॉन्स्ट) प्रक्रियाओं के रूप में माना जाता है।
अक्सर, रासायनिक ऊष्मप्रवैगिकी में, प्रतिक्रियाओं को माना जाता है जो मानक परिस्थितियों में होती हैं, अर्थात। सभी पदार्थों के मानक तापमान और मानक अवस्था पर . 298K का तापमान मानक के रूप में लिया जाता है। किसी पदार्थ की मानक अवस्था 101.3 kPa के दाब पर उसकी अवस्था होती है। यदि पदार्थ घोल में है, तो इसकी अवस्था 1 mol / L की सांद्रता में मानक के रूप में ली जाती है।
प्रक्रियाओं को चिह्नित करने के लिए, रासायनिक थर्मोडायनामिक्स राज्य के कार्यों नामक विशेष मात्रा के साथ संचालित होता है: यू - आंतरिक ऊर्जा, एच - थैलेपी, एस - एन्ट्रॉपी, जी - गिब्स ऊर्जा, और एफ - हेल्महोल्ट्ज ऊर्जा। किसी भी प्रक्रिया की मात्रात्मक विशेषताओं में राज्य के कार्यों में परिवर्तन होते हैं, जो रासायनिक थर्मोडायनामिक्स के तरीकों से निर्धारित होते हैं: U, ΔH, ΔS, ΔG, F।
थर्मोकेमिकल गणना में प्रतिक्रिया के गर्मी प्रभाव (प्रतिक्रिया की गर्मी) का निर्धारण होता है। प्रतिक्रिया की गर्मी जारी या अवशोषित गर्मी की मात्रा है क्यू .यदि अभिक्रिया के दौरान ऊष्मा निकलती है, तो ऐसी अभिक्रिया ऊष्माक्षेपी कहलाती है; यदि ऊष्मा अवशोषित हो जाती है, तो अभिक्रिया ऊष्माशोषी कहलाती है।
अभिक्रिया की ऊष्मा का संख्यात्मक मान इस बात पर निर्भर करता है कि यह कैसे किया जाता है। आइसोकोरिक प्रक्रिया में किया जाता है वी = कॉन्स्ट , प्रतिक्रिया की गर्मी q वी = Δ यू, समदाब रेखीय प्रक्रम में p = . पर स्थिरांक थर्मल प्रभाव क्यूपी = Δ एच। इस प्रकार, थर्मोकेमिकल गणना में प्रतिक्रिया के दौरान आंतरिक ऊर्जा या थैलेपी में परिवर्तन के परिमाण को निर्धारित करना शामिल है। चूंकि अधिकांश प्रतिक्रियाएं आइसोबैरिक स्थितियों के तहत आगे बढ़ती हैं (उदाहरण के लिए, वायुमंडलीय दबाव में आगे बढ़ने वाले खुले जहाजों में ये सभी प्रतिक्रियाएं हैं), थर्मोकेमिकल गणना करते समय, की गणना लगभग हमेशा की जाती है। अगर Δ एच<0, то реакция экзотермическая, если же Δ एच> 0, तो प्रतिक्रिया एंडोथर्मिक है।
थर्मोकेमिकल गणना हेस के नियम से एक कोरोलरी का उपयोग करके की जाती है : अभिक्रिया का उष्मा प्रभाव अभिक्रिया उत्पादों के निर्माण की उष्मा (एंथैल्पी) के योग के बराबर होता है, अभिकारकों के बनने की ऊष्मा (एंथैल्पी) के योग के बराबर होता है।
आइए प्रतिक्रिया समीकरण को सामान्य रूप में लिखें: aA + bB = cC + dD। हेस के नियम के परिणाम के अनुसार, प्रतिक्रिया की गर्मी सूत्र द्वारा निर्धारित की जाती है:
Δ एच = (सीΔ एच गिरफ्तारी, सी + डीΔ एच गिरफ्तारी, डी) - (ए .)Δ एच गिरफ्तारी, ए + बीΔ एच गिरफ्तार, बी),जहां एच -प्रतिक्रिया की गर्मी; गिरफ्तारी - प्रतिक्रिया उत्पादों सी और डी और अभिकर्मकों ए और बी के क्रमशः गठन की गर्मी (एंथैल्पी); सी, डी, ए, बी - प्रतिक्रिया समीकरण में गुणांक, जिसे स्टोइकोमेट्रिक और गुणांक कहा जाता है।
इस सूत्र में मूल मात्राएँ अभिकर्मकों और उत्पादों के निर्माण की ऊष्मा (एंथैल्पी) हैं। एक यौगिक के गठन की गर्मी (एंथैल्पी) प्रतिक्रिया का गर्मी प्रभाव है, जिसके दौरान इस यौगिक का 1 मोल थर्मोडायनामिक रूप से स्थिर चरणों में सरल पदार्थों से बनता है और संशोधन होता है . उदाहरण के लिए, वाष्प अवस्था में पानी के बनने की गर्मी प्रतिक्रिया की आधी गर्मी के बराबर होती है, जिसे समीकरण द्वारा व्यक्त किया जाता है: 2H 2 (g) + O 2 (g) = 2H 2 O (g)। गठन की गर्मी का आयाम kJ / mol है।
थर्मोकेमिकल गणना में, प्रतिक्रियाओं की गर्मी आमतौर पर मानक स्थितियों के लिए निर्धारित की जाती है, जिसके लिए सूत्र रूप लेता है: ° 298 = (cΔН ° 298 नमूना С + dΔН ° 298 नमूना D) - (аΔН ° 298 о6р A + bΔН ° 298 नमूना बी), जहां ΔН ° 298 kJ में प्रतिक्रिया की मानक गर्मी है (मानक मान सुपरस्क्रिप्ट "O" द्वारा इंगित किया गया है) 298K के तापमान पर, और ° 298 गिरफ्तारी। - यौगिकों के निर्माण की मानक ऊष्मा (एंथैल्पी) भी 298K के तापमान पर होती है। ° 298rev का मान। सभी कनेक्शनों के लिए परिभाषित हैं और सारणीबद्ध डेटा हैं।
प्रतिक्रिया की गिब्स ऊर्जा गिब्स ऊर्जा में परिवर्तन हैΔ जी जब एक रासायनिक प्रतिक्रिया होती है। चूंकि सिस्टम G = H - TS की गिब्स ऊर्जा, प्रक्रिया में इसका परिवर्तन सूत्र द्वारा निर्धारित किया जाता है: जी = Δ एच - टीΔ एस,जहां T परम तापमान है, K.
एक रासायनिक प्रतिक्रिया की गिब्स ऊर्जा निरंतर दबाव और तापमान पर इसकी सहज घटना की संभावना की विशेषता है (पी = स्थिरांक, टी = स्थिरांक पर)। अगर Δ जी< 0, то реакция может протекать самопроизвольно, при Δ G> 0 स्वतःस्फूर्त प्रतिक्रिया असंभव है यदि Δ जी = 0, प्रणाली संतुलन में है।
प्रतिक्रिया की गिब्स ऊर्जा की गणना करने के लिए, और ΔS अलग-अलग निर्धारित किए जाते हैं। इस मामले में, ज्यादातर मामलों में, प्रतिक्रिया की स्थिति पर थैलेपी और एन्ट्रापी ΔS में परिवर्तन के मूल्यों की कमजोर निर्भरता का उपयोग किया जाता है, अर्थात। सन्निकटन का उपयोग करें: = H ° 298 और ΔS = ΔS ° 298।
प्रतिक्रिया की मानक गर्मी ° 298 हेस के नियम से एक कोरोलरी का उपयोग करके निर्धारित की जाती है, और प्रतिक्रिया की मानक एन्ट्रापी аА + bВ = сС + dD की गणना सूत्र द्वारा की जाती है: ΔS ° 298 = (сS ° 298 नमूना С + dS ° 298, नमूना डी) - (एएस ° 298 नमूना + बीएस ° 298 नमूना बी), जहां S ° 298 J / (molK) में यौगिकों के पूर्ण मानक एन्ट्रापी के सारणीबद्ध मान हैं, और ΔS ° 298 मानक है जे / के में प्रतिक्रिया की एन्ट्रॉपी।
यदि प्रतिक्रिया 298K के तापमान पर मानक परिस्थितियों में आगे बढ़ती है, तो इसकी गिब्स ऊर्जा (प्रतिक्रिया की मानक गिब्स ऊर्जा) की गणना सूत्र का उपयोग करके प्रतिक्रिया की मानक गर्मी की गणना के समान की जा सकती है, जो कि प्रतिक्रिया के लिए व्यक्त की जाती है समीकरण aA + bB = cC + dD का रूप है:
जी ° 298 = (सीΔजी ° 298 सी + डीΔजी ° 298 डी) - (एजी) ° 298 ए + बीΔजी ° 298 बी), जहां G ° 298 - यौगिक निर्माण की मानक गिब्स ऊर्जा kJ/mol (सारणीबद्ध मान) में - प्रतिक्रिया की गिब्स ऊर्जा, जिसमें 298K के तापमान पर मानक अवस्था में दिए गए यौगिक का 1 मोल साधारण पदार्थों से बनता है जो मानक अवस्था में भी होते हैं,और जी ° 298 kJ में प्रतिक्रिया की मानक गिब्स ऊर्जा है।
उद्देश्य 1.इस अभिक्रिया के लिए 2SO 2 (g) + O 2 (g) = 2SO 3 (g), एन्थैल्पी 298, एन्ट्रॉपी ΔS 298 और गिब्स ऊर्जा ΔG 298 में परिवर्तन की गणना करें। सहज प्रतिक्रिया तापमान सीमा की गणना करें। मानक स्थितियों के तहत इस प्रतिक्रिया के संतुलन स्थिरांक की गणना करें (मानक थर्मोडायनामिक क्षमता की तालिकाएं विभिन्न संदर्भ पुस्तकों में दी गई हैं)।
एन्थैल्पी गणना (ΔН 298 °):
° 298 = प्रतिक्रिया उत्पाद - Н अभिकर्मक
मानक थर्मोडायनामिक क्षमता की तालिका के परिशिष्ट से, हम प्रतिक्रिया में भाग लेने वाले पदार्थों के लिए एच ° 298 के मूल्यों का चयन करते हैं और उन्हें गणना सूत्र में प्रतिस्थापित करते हैं:
° 298 = Δ प्रतिक्रिया उत्पाद - अभिकर्मक = 2 298 ° (SO 3) - (2 298 ° (SO 2) + 298 ° (O 2)) = = 2 (−395.2) - (2 (−296.9) + 0) = - 197.2 kJ / mol
एन्ट्रापी गणना (ΔS ° 298):
S ° 298 = S प्रतिक्रिया उत्पाद - S अभिकर्मक
मानक थर्मोडायनामिक क्षमता की तालिका से, हम प्रतिक्रिया में भाग लेने वाले पदार्थों के लिए S ° 298 के मूल्यों का चयन करते हैं और उन्हें गणना सूत्र में प्रतिस्थापित करते हैं:
ΔS ° 298 = Σ S प्रतिक्रिया उत्पाद - S अभिकर्मक = 2 S ° 298 (SO 3) - (2 S ° 298 (SO 2) + ΔS ° 298 (О 2)) =
=2∙ 256,2 – (2∙248,1 +205) = –188,8 = –0,1888 .
गिब्स ऊर्जा की गणना (Δ जी ° 298):
जी ° 298 = Δ एन ° 298 - टी ΔS ° 298
प्राप्त आंकड़ों से, हम गिब्स ऊर्जा की गणना करते हैं (मानक परिस्थितियों में टी = 298 के):
G ° 298 = Δ ° 298 -T S ° 298 = −197.2 kJ / mol - 298 ∙ (–0.1888) = -140.9 kJ / mol।
गणना से पता चलता है कि 25ºC (298K) पर ऑक्सीजन के साथ सल्फर डाइऑक्साइड का ऑक्सीकरण थर्मोडायनामिक रूप से संभव प्रक्रिया है (∆G के बाद से)<0). В ходе этой реакции энтропия уменьшается и, следовательно, с ростом температуры уменьшается возможность протекания этой реакции.
प्रतिक्रिया के सहज पाठ्यक्रम की तापमान सीमा का निर्धारण.
चूंकि प्रतिक्रिया की सहज घटना के लिए शर्त डीजी (डीजी .) की नकारात्मकता है<0), определение области температур, в которой реакция может протекать самопроизвольно, сводится к решению неравенства (DH–TDS)<0 относительно температуры.
सैद्धांतिक जानकारी
रासायनिक प्रक्रिया को रासायनिक वस्तुओं - इलेक्ट्रॉन, प्रोटॉन, परमाणु - से एक जीवित प्रणाली में चढ़ाई में पहला कदम माना जा सकता है।
रासायनिक प्रक्रियाओं का सिद्धांत- यह विज्ञान का वह क्षेत्र है जिसमें भौतिकी, रसायन विज्ञान, जीव विज्ञान का गहनतम अंतर्विरोध है। यह सिद्धांत रासायनिक थर्मोडायनामिक्स और कैनेटीक्स पर आधारित है।
किसी पदार्थ की रासायनिक परिवर्तनों से गुजरने की क्षमता उनकी प्रतिक्रियाशीलता से निर्धारित होती है, अर्थात। प्रतिक्रियाशील पदार्थों की प्रकृति - रासायनिक बंधन की संरचना, संरचना, प्रकृति; ऊर्जा कारक जो प्रक्रिया की संभावना और गतिज कारक निर्धारित करते हैं जो इसके पाठ्यक्रम की दर निर्धारित करते हैं।
लगभग सभी रासायनिक प्रक्रियाएं ऊर्जा की रिहाई या अवशोषण के साथ होती हैं, अक्सर गर्मी और काम के रूप में।
गरमाहट -किसी दिए गए सिस्टम को बनाने वाले कणों के यादृच्छिक अराजक आंदोलन का मात्रात्मक माप।
काम -एक निर्देशित बल क्षेत्र में कणों की क्रमबद्ध गति का मात्रात्मक माप।
रसायन विज्ञान का वह भाग जो रासायनिक अभिक्रियाओं के दौरान ऊर्जा के एक रूप से दूसरे रूप में संक्रमण का अध्ययन करता है और दी गई परिस्थितियों में उनके सहज प्रवाह की दिशा और सीमा को स्थापित करता है, कहलाता है रासायनिक ऊष्मप्रवैगिकी .
रासायनिक ऊष्मप्रवैगिकी के अध्ययन का उद्देश्य एक रासायनिक प्रणाली है।
प्रणाली -यह अध्ययन किया गया निकाय या निकायों का एक समूह है जो एक दूसरे के साथ बातचीत करते हैं और मानसिक रूप से या वास्तव में पर्यावरण से सीमाओं से अलग होते हैं जो गर्मी का संचालन करते हैं या नहीं करते हैं।
पर्यावरण के साथ प्रणाली की अंतःक्रिया की प्रकृति के आधार पर, एक अंतर किया जाता है खुला, बंद और पृथकसिस्टम
ओपन सिस्टमपर्यावरण के साथ ऊर्जा और पदार्थ का आदान-प्रदान कर सकते हैं। उदाहरण के लिए, एक खुले बर्तन में सोडियम क्लोराइड का जलीय घोल। जब पानी एक घोल से वाष्पित हो जाता है और हीट एक्सचेंज के दौरान, सिस्टम का द्रव्यमान और उसका तापमान बदल जाएगा, और, परिणामस्वरूप, ऊर्जा।
बंद सिस्टमपर्यावरण के साथ पदार्थ का आदान-प्रदान न करें। उदाहरण के लिए, बंद बर्तन में सोडियम क्लोराइड का घोल। यदि घोल और वातावरण का तापमान अलग-अलग है, तो घोल को गर्म या ठंडा किया जाएगा, और इसलिए इसकी ऊर्जा बदल जाएगी।
पृथक सिस्टमवे पर्यावरण के साथ पदार्थ या ऊर्जा का आदान-प्रदान नहीं कर सकते हैं। एक पृथक प्रणाली आदर्शीकरण है। प्रकृति में ऐसी कोई व्यवस्था नहीं है। लेकिन, व्यावहारिक कार्यान्वयन की असंभवता के बावजूद, पृथक सिस्टम सिस्टम और उसके पर्यावरण के बीच अधिकतम सैद्धांतिक ऊर्जा अंतर को निर्धारित करना संभव बनाता है।
सिस्टम की स्थिति गुणों के एक सेट द्वारा निर्धारित की जाती है और इसकी विशेषता होती है थर्मोडायनामिक पैरामीटर : तापमान (), दबाव (), आयतन (), घनत्व (), पदार्थ की मात्रा (), कार्य द्वारा निष्पादित (), ऊष्मा ()। कम से कम एक थर्मोडायनामिक पैरामीटर में बदलाव से पूरे सिस्टम की स्थिति में बदलाव आता है। यदि सभी पैरामीटर समय और स्थान में स्थिर हैं, तो सिस्टम की ऐसी स्थिति को कहा जाता है संतुलन .
ऊष्मप्रवैगिकी में, एक प्रणाली के गुणों को इसके संतुलन राज्यों में माना जाता है: प्रारंभिक और अंतिम, एक राज्य से दूसरे राज्य में सिस्टम के संक्रमण के मार्ग की परवाह किए बिना। प्रणाली का एक राज्य से दूसरे राज्य में संक्रमण, = स्थिरांकबुलाया समदाब रेखीय-समतापीय,पर, = स्थिरांक– आइसोकोरिक-इज़ोटेर्मल।
रासायनिक ऊष्मप्रवैगिकी का सबसे महत्वपूर्ण कार्य किसी विशेष रासायनिक प्रतिक्रिया की प्रक्रिया की सहज घटना की संभावना या असंभवता को दी गई परिस्थितियों में और एक निश्चित दिशा में स्पष्ट करना है; थर्मोडायनामिक मापदंडों का मूल्य स्थापित करना जिस पर प्रक्रिया का अधिकतम उत्पादन प्राप्त होता है; प्रणाली में हो रहे ऊर्जा परिवर्तन की विशेषताओं का निर्धारण। इसके साथ खोजें थर्मोडायनामिक फ़ंक्शन ()।
राज्य समारोह की विशेषता है प्रणाली की आंतरिक ऊर्जा – शरीर के सभी कणों की एक दूसरे के साथ परस्पर क्रिया की स्थितिज ऊर्जा और उनकी गति की गतिज ऊर्जा का योग। यह पदार्थ की स्थिति पर निर्भर करता है - प्रकार, द्रव्यमान, एकत्रीकरण की स्थिति। आंतरिक ऊर्जा के निरपेक्ष मूल्य को मापना असंभव है। रासायनिक प्रक्रियाओं का अध्ययन करने के लिए, केवल एक राज्य से दूसरे राज्य में प्रणाली के संक्रमण के दौरान आंतरिक ऊर्जा में परिवर्तन को जानना महत्वपूर्ण है।
 (27)
(27)
जिसमें  सिस्टम की आंतरिक ऊर्जा कम हो जाती है, पर
सिस्टम की आंतरिक ऊर्जा कम हो जाती है, पर  - बढ़ती है। आंतरिक ऊर्जा में सभी परिवर्तन अणुओं की अराजक टक्कर के कारण होते हैं (इस तरह से स्थानांतरित ऊर्जा का माप गर्मी है) और किसी भी बल की कार्रवाई के तहत बड़ी संख्या में कणों से मिलकर द्रव्यमान की गति (माप की माप) इस तरह से स्थानांतरित ऊर्जा कार्य है)। इस प्रकार, आंतरिक ऊर्जा का हस्तांतरण आंशिक रूप से गर्मी के रूप में और आंशिक रूप से कार्य के रूप में किया जा सकता है:
- बढ़ती है। आंतरिक ऊर्जा में सभी परिवर्तन अणुओं की अराजक टक्कर के कारण होते हैं (इस तरह से स्थानांतरित ऊर्जा का माप गर्मी है) और किसी भी बल की कार्रवाई के तहत बड़ी संख्या में कणों से मिलकर द्रव्यमान की गति (माप की माप) इस तरह से स्थानांतरित ऊर्जा कार्य है)। इस प्रकार, आंतरिक ऊर्जा का हस्तांतरण आंशिक रूप से गर्मी के रूप में और आंशिक रूप से कार्य के रूप में किया जा सकता है:
 (28)
(28)
उपरोक्त समीकरण एक गणितीय व्यंजक है ऊष्मप्रवैगिकी के कानून के I : यदि सिस्टम को गर्मी की आपूर्ति की जाती है, तो आपूर्ति की गई गर्मी सिस्टम की आंतरिक ऊर्जा को बढ़ाने और इसके लिए काम करने के लिए खर्च की जाती है।
आइसोकोरिक-इज़ोटेर्मल प्रक्रिया में, सिस्टम को आपूर्ति की जाने वाली सभी गर्मी आंतरिक ऊर्जा को बदलने पर खर्च की जाती है:
 (29)
(29)
आइसोबैरिक-इज़ोटेर्मल प्रक्रिया में, सिस्टम द्वारा किया जाने वाला एकमात्र प्रकार का कार्य विस्तार कार्य है:
 (30)
(30)
सिस्टम में दबाव कहां है, मात्रा में परिवर्तन है
तब ऊष्मप्रवैगिकी के I कानून की गणितीय अभिव्यक्ति रूप लेती है:  (31)
(31)
नामित करके  , हम पाते हैं
, हम पाते हैं 
सिस्टम स्टेट फंक्शन एच - तापीय धारिता प्रणाली की कुल ऊर्जा आपूर्ति है, अर्थात। यह प्रणाली की ऊर्जा सामग्री है। निकाय की एन्थैल्पी कार्य की मात्रा से आंतरिक ऊर्जा से अधिक होती है।
प्रतिक्रिया के दौरान ऊर्जा अभिव्यक्तियों को चिह्नित करने के लिए, अवधारणा पेश की गई थी थर्मल प्रभाव।
गर्मी प्रभाव- यह गर्मी की मात्रा है जो प्रतिक्रिया के अपरिवर्तनीय पाठ्यक्रम के दौरान जारी या अवशोषित होती है, जब एकमात्र कार्य विस्तार का कार्य होगा। इस मामले में, प्रारंभिक सामग्री और प्रतिक्रिया उत्पादों का तापमान समान होना चाहिए। गर्मी प्रभाव ऊष्माशोषी अभिक्रिया(गर्मी अवशोषण के साथ बहता है) सकारात्मक होगा:  ,
,  ... गर्मी प्रभाव उष्माक्षेपी प्रतिक्रिया(गर्मी के निकलने के साथ आगे बढ़ें) ऋणात्मक होगा:
... गर्मी प्रभाव उष्माक्षेपी प्रतिक्रिया(गर्मी के निकलने के साथ आगे बढ़ें) ऋणात्मक होगा:  ,
,  .
.
रासायनिक प्रतिक्रियाओं के ऊष्मीय प्रभावों के अध्ययन के लिए समर्पित रसायन विज्ञान के खंड को कहा जाता है ऊष्मारसायन .
किसी भी रासायनिक प्रतिक्रिया के साथ प्रतिक्रियाशील पदार्थों के ऊर्जा भंडार में परिवर्तन होता है। एक रासायनिक यौगिक के निर्माण के दौरान जितनी अधिक ऊर्जा निकलती है, यह यौगिक उतना ही अधिक स्थिर होता है, और, इसके विपरीत, एक एंडोथर्मिक प्रतिक्रिया के परिणामस्वरूप प्राप्त पदार्थ अस्थिर होता है।
रासायनिक समीकरणों में जिसमें अभिक्रिया की ऊष्मा का संकेत दिया जाता है, वे कहलाते हैं थर्मोकेमिकल।इन्हें द्रव्यमान और ऊर्जा के संरक्षण के नियमों के आधार पर संकलित किया जाता है।
विभिन्न प्रक्रियाओं के ऊष्मीय प्रभावों की तुलना करने के लिए, उनकी घटना की शर्तों को मानकीकृत किया जाता है। मानक स्थितियाँ - T 0 = 298 K, p 0 = 101.313 kPa, n - 1 mol शुद्ध पदार्थ, एन्थैल्पी परिवर्तन (  ) किसी पदार्थ की एक इकाई मात्रा, kJ / mol को संदर्भित करता है। सभी मानक थर्मोडायनामिक फ़ंक्शन सारणीबद्ध मान हैं, जो पदार्थ के एकत्रीकरण की स्थिति पर निर्भर करता है।
) किसी पदार्थ की एक इकाई मात्रा, kJ / mol को संदर्भित करता है। सभी मानक थर्मोडायनामिक फ़ंक्शन सारणीबद्ध मान हैं, जो पदार्थ के एकत्रीकरण की स्थिति पर निर्भर करता है।
थर्मोकैमिस्ट्री के मात्रात्मक कानून थर्मोडायनामिक्स के पहले कानून से पालन करते हैं।
लैवोजियर-लाप्लास कानून(1780 - 1784) - प्रत्येक रासायनिक यौगिक के लिए, अपघटन की गर्मी उसके गठन की गर्मी के बराबर होती है, लेकिन इसका विपरीत संकेत होता है।
जीआई का कानून हेस्सो(1840) - एक रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव प्रारंभिक पदार्थों और अंतिम उत्पादों की प्रकृति और भौतिक स्थिति पर निर्भर करता है, लेकिन प्रतिक्रिया की प्रकृति और पथ पर निर्भर नहीं करता है, अर्थात। व्यक्तिगत मध्यवर्ती चरणों के अनुक्रम से।यह नियम थर्मोकैमिस्ट्री का सैद्धांतिक आधार है। इसके कई परिणाम सामने आते हैं:
थर्मोकेमिकल गणना में, मानक परिस्थितियों में सरल पदार्थों के गठन की गर्मी (एंथैल्पी) को शून्य माना जाता है।
 (सरल पदार्थ) = 0
(सरल पदार्थ) = 0
मानक परिस्थितियों में साधारण पदार्थों से जटिल पदार्थ के 1 मोल के निर्माण के दौरान जारी या अवशोषित ऊर्जा की मात्रा को गठन की मानक थैलीपी कहा जाता है (  , केजे / मोल)।
, केजे / मोल)।
मानक परिस्थितियों में कार्बन डाइऑक्साइड और पानी में विघटित होने वाले कार्बनिक पदार्थ के 1 मोल द्वारा मुक्त या अवशोषित ऊर्जा की मात्रा को दहन की मानक थैलीपी कहा जाता है (  , केजे / मोल)।
, केजे / मोल)।
एक रासायनिक प्रतिक्रिया का गर्मी प्रभाव प्रतिक्रिया उत्पादों के गठन की गर्मी के योग और प्रारंभिक पदार्थों के गठन की गर्मी के योग के बीच अंतर के बराबर है, स्टोइकोमेट्रिक गुणांक को ध्यान में रखते हुए:
मानक परिस्थितियों में रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव कहाँ होता है;  - प्रतिक्रिया उत्पादों के गठन के मानक तापों का योग;
- प्रतिक्रिया उत्पादों के गठन के मानक तापों का योग;  - प्रारंभिक सामग्री के गठन के मानक तापों का योग;
- प्रारंभिक सामग्री के गठन के मानक तापों का योग;  ,
,  - प्रतिक्रिया उत्पादों और प्रारंभिक सामग्री के क्रमशः स्टोइकोमेट्रिक गुणांक।
- प्रतिक्रिया उत्पादों और प्रारंभिक सामग्री के क्रमशः स्टोइकोमेट्रिक गुणांक।
हेस का नियम आपको विभिन्न प्रतिक्रियाओं के थर्मल प्रभावों की गणना करने की अनुमति देता है। लेकिन थर्मल प्रभाव का संकेत और परिमाण प्रक्रियाओं की क्षमता को अनायास आगे बढ़ने की अनुमति नहीं देता है और इसमें प्रक्रियाओं की दिशा और पूर्णता के बारे में जानकारी नहीं होती है।
स्वतःस्फूर्त प्रक्रियाएं(प्राकृतिक या सकारात्मक) - बाहरी वातावरण के हस्तक्षेप के बिना सिस्टम में आगे बढ़ें और सिस्टम की आंतरिक ऊर्जा में कमी और गर्मी और काम के रूप में पर्यावरण में ऊर्जा के हस्तांतरण के साथ हैं। एंडोथर्मिक स्वतःस्फूर्त प्रक्रियाएं इस परिभाषा का खंडन नहीं करती हैं, क्योंकि वे एक अछूता प्रणाली में हो सकती हैं और पर्यावरण की गर्मी के कारण काम कर सकती हैं।
वे प्रक्रियाएँ जो स्वयं (बाहरी प्रभाव के बिना) नहीं हो सकतीं कहलाती हैं गैर सहज , अप्राकृतिक या नकारात्मक। इस तरह की प्रक्रियाओं को गर्मी या काम के रूप में बाहरी वातावरण से ऊर्जा को सिस्टम में स्थानांतरित करके किया जाता है।
ऊष्मप्रवैगिकी के द्वितीय नियम के अनुसार, स्वतःस्फूर्त प्रक्रियाएं प्रणाली की आंतरिक ऊर्जा या एन्थैल्पी की आपूर्ति को कम करती हैं। हालांकि, ऐसी प्रक्रियाओं को जाना जाता है जो सिस्टम की आंतरिक ऊर्जा को बदले बिना अनायास ही आगे बढ़ जाती हैं। ऐसी प्रक्रियाओं की प्रेरक शक्ति प्रणाली की एन्ट्रापी है।
एन्ट्रापी(बाध्य ऊर्जा) (
एस)
प्रक्रिया की अपरिवर्तनीयता का एक उपाय है, ऊर्जा के एक ऐसे रूप में संक्रमण का एक उपाय है जिससे वह स्वतंत्र रूप से दूसरी ऊर्जा में नहीं जा सकता है। एन्ट्रापी प्रणाली में विकार की विशेषता है, विकार जितना अधिक होगा, एन्ट्रापी उतनी ही अधिक होगी। यह कण गति में वृद्धि के साथ बढ़ता है। बाहरी वातावरण से पृथक प्रणालियों में, एन्ट्रापी () को बढ़ाने की दिशा में प्रक्रियाएँ अनायास चलती हैं। वे प्रक्रियाएँ जिनके लिए एन्ट्रापी घटती है (  ) पृथक प्रणालियों में संभव नहीं हैं। यदि प्रक्रिया आगे और पीछे की दिशाओं में संभव है, तो एक पृथक प्रणाली में यह एन्ट्रापी बढ़ाने की दिशा में आगे बढ़ेगी। एक पृथक प्रणाली में एक सहज प्रक्रिया का पाठ्यक्रम संतुलन की स्थिति में समाप्त होता है। इसलिए, संतुलन की स्थिति में सिस्टम एन्ट्रॉपी ज्यादा से ज्यादा
.
) पृथक प्रणालियों में संभव नहीं हैं। यदि प्रक्रिया आगे और पीछे की दिशाओं में संभव है, तो एक पृथक प्रणाली में यह एन्ट्रापी बढ़ाने की दिशा में आगे बढ़ेगी। एक पृथक प्रणाली में एक सहज प्रक्रिया का पाठ्यक्रम संतुलन की स्थिति में समाप्त होता है। इसलिए, संतुलन की स्थिति में सिस्टम एन्ट्रॉपी ज्यादा से ज्यादा
.
बोल्ट्जमैन ने एक समीकरण व्युत्पन्न किया जिसके अनुसार
(34) जहां बोल्ट्जमैन स्थिरांक है, डब्ल्यू एक राज्य की संभावना है, किसी दिए गए माइक्रोस्टेट के अनुरूप माइक्रोस्टेट की संख्या निर्धारित करता है।
इस संबंध से पता चलता है कि एन्ट्रापी को प्रणाली के आणविक विकार के माप के रूप में माना जा सकता है।
एक इज़ोटेर्मल प्रक्रिया के लिए ऊष्मप्रवैगिकी के द्वितीय नियम के अनुसार, एन्ट्रापी में परिवर्तन के बराबर है:
 ; [जे / (मोल · के] (35)
; [जे / (मोल · के] (35)
सरल पदार्थों की एन्ट्रापी शून्य नहीं होती है। एन्थैल्पी के विपरीत, आप एन्ट्रापी के निरपेक्ष मान को माप सकते हैं। "निरपेक्ष शून्य पर, एक आदर्श क्रिस्टल की एन्ट्रापी शून्य होती है" - एम. प्लैंक (1911) के इस अभिधारणा को कहा जाता है ऊष्मप्रवैगिकी के नियम द्वारा III।
रासायनिक प्रक्रिया की एन्ट्रापी में परिवर्तन संतुलन समीकरण द्वारा निर्धारित किया जाता है:
किसी भी प्रणाली की विशेषता क्रम () और विकार () होती है। उनका अनुपात प्रतिक्रिया की दिशा निर्धारित करता है।
इस प्रकार, एक स्थिर अवस्था की ओर प्रणाली की सहज गति के साथ, दो प्रवृत्तियाँ प्रकट होती हैं: थैलेपी में कमी  और एन्ट्रापी में वृद्धि। स्थिर तापमान और दबाव पर दो प्रवृत्तियों का संयुक्त प्रभाव दर्शाता है समदाब रेखीय-समतापीय विभव या गिब्स ऊर्जा ()
.
और एन्ट्रापी में वृद्धि। स्थिर तापमान और दबाव पर दो प्रवृत्तियों का संयुक्त प्रभाव दर्शाता है समदाब रेखीय-समतापीय विभव या गिब्स ऊर्जा ()
.
राज्य समारोह
प्रक्रिया की सामान्य प्रेरक शक्ति की विशेषता है, सिस्टम द्वारा निष्पादित अधिकतम संभव उपयोगी कार्य ("मुक्त ऊर्जा");  - ऊर्जा का एक हिस्सा जिसे उपयोगी कार्य ("बाध्य ऊर्जा") में परिवर्तित नहीं किया जा सकता है।
- ऊर्जा का एक हिस्सा जिसे उपयोगी कार्य ("बाध्य ऊर्जा") में परिवर्तित नहीं किया जा सकता है।
मात्रा में परिवर्तन के साथ एक खुले बर्तन में रासायनिक प्रतिक्रियाएं होती हैं, इसलिए संभावना (सहजता) और प्रक्रिया की दिशा मानक स्थितियों के तहत संतुलन समीकरण द्वारा निर्धारित एक फ़ंक्शन द्वारा विशेषता है:
;  (38)
(38)
प्रक्रिया का सहज क्रम गिब्स ऊर्जा में कमी से मेल खाता है,  ... जितना अधिक यह घटता है, उतनी ही अपरिवर्तनीय रूप से प्रक्रिया प्रतिक्रिया के अंतिम उत्पादों के निर्माण की ओर बढ़ती है। बढ़ी हुई आइसोबैरिक क्षमता
... जितना अधिक यह घटता है, उतनी ही अपरिवर्तनीय रूप से प्रक्रिया प्रतिक्रिया के अंतिम उत्पादों के निर्माण की ओर बढ़ती है। बढ़ी हुई आइसोबैरिक क्षमता  दी गई शर्तों के तहत प्रक्रिया की अव्यवहारिकता का एक संकेत है। अर्थ
दी गई शर्तों के तहत प्रक्रिया की अव्यवहारिकता का एक संकेत है। अर्थ  संतुलन की स्थिति की विशेषता है, अर्थात। एक राज्य जिसमें सिस्टम उपयोगी कार्य नहीं करता है।
संतुलन की स्थिति की विशेषता है, अर्थात। एक राज्य जिसमें सिस्टम उपयोगी कार्य नहीं करता है।
मात्राओं और गिब्स समीकरण के विश्लेषण से पता चला है कि प्रक्रिया के प्रतिवर्ती पाठ्यक्रम की संभावना समान संकेतों के कारण है और। एक निश्चित तापमान पर, मान और  समान हो जाना। इसलिए, गिब्स समीकरण से, कोई "संतुलन" तापमान या प्रक्रिया की शुरुआत का तापमान निर्धारित कर सकता है ():
समान हो जाना। इसलिए, गिब्स समीकरण से, कोई "संतुलन" तापमान या प्रक्रिया की शुरुआत का तापमान निर्धारित कर सकता है ():
 ; = 0
;
; = 0
;  ;
;  (39)
(39)
इस प्रकार, प्रतिक्रियाएँ स्वतःस्फूर्त रूप से होती हैं जिनमें मुक्त ऊर्जा में परिवर्तन नकारात्मक होता है। प्रतिक्रियाएं जिनमें  , केवल इस शर्त के तहत आगे बढ़ें कि सिस्टम पर बाहरी ताकतों द्वारा काम किया जाता है या ऊर्जा को बाहर से सिस्टम में स्थानांतरित किया जाता है। सहज प्रक्रिया की स्थिति अंजीर में दिखाई गई है। 3.
, केवल इस शर्त के तहत आगे बढ़ें कि सिस्टम पर बाहरी ताकतों द्वारा काम किया जाता है या ऊर्जा को बाहर से सिस्टम में स्थानांतरित किया जाता है। सहज प्रक्रिया की स्थिति अंजीर में दिखाई गई है। 3.
रासायनिक प्रतिक्रियाएं, रासायनिक प्रतिक्रियाएं,
अनायास बहना अनायास नहीं बहना


ऊष्माक्षेपी अभिक्रियाएँ, ऊष्माक्षेपी अभिक्रियाएँ,
साथ में
एन्ट्रापी में वृद्धि एन्ट्रापी में कमी
पर कोई भीतापमान उच्चतापमान
ऊष्माशोषी अभिक्रियाएँ
साथ में
बढ़ती हुई एन्ट्रापी
पर कमतापमान
चावल। 3. प्रक्रिया के स्वतःस्फूर्त पाठ्यक्रम के लिए शर्तें।
3.2. प्रश्नों और कार्यों को नियंत्रित करें
1. प्रणाली क्या कहलाती है? सिस्टम के पैरामीटर क्या हैं?
2. तंत्र की आंतरिक ऊर्जा, समद्विबाहु और समदाबीय प्रक्रियाओं की अवधारणा का वर्णन करें।
3. एन्थैल्पी किसे कहते हैं?
4. यौगिकों के बनने की एन्थैल्पी, दहन की मानक एन्थैल्पी और पदार्थों के निर्माण का वर्णन करें।
5. हेस का नियम और उसके परिणाम, थर्मोकेमिकल गणना में इसका अनुप्रयोग।
6. उदासीनीकरण, विघटन, जलयोजन की ऊष्मा (एंथैल्पी) का निर्धारण।
7. एन्ट्रापी। बोल्ट्जमैन समीकरण। तापमान के साथ एन्ट्रापी कैसे बदलती है?
8. गिब्स ऊर्जा। प्रक्रिया के सहज पाठ्यक्रम के लिए मानदंड।
9. परिशिष्ट 3 में संदर्भ डेटा का उपयोग करते हुए, प्रतिक्रिया की मानक थैलीपी में परिवर्तन की गणना करें ():
10. परिशिष्ट 3 में संदर्भ डेटा का उपयोग करके, प्रतिक्रिया की मानक एन्ट्रॉपी में परिवर्तन की गणना करें (  ):
):
11. 846 0 पर अभिक्रियाओं की गणना कीजिए, यदि = 230 kJ,  = 593 जे / के।
= 593 जे / के।
समस्या समाधान के उदाहरण
उदाहरण 1।एथिल अल्कोहल की दहन प्रतिक्रिया थर्मोकेमिकल समीकरण C 2 H 5 OH (Zh) + 3O 2 (G) = 2CO 2 (G) + 3H 2 O (Zh) द्वारा व्यक्त की जाती है। प्रतिक्रिया की गर्मी की गणना करें यदि यह ज्ञात है कि सी 2 एच 5 ओएच (जेडएच) के वाष्पीकरण की दाढ़ गर्मी +42.36 केजे है, और सी 2 एच 5 ओएच (जी) = -235.31 केजे, सीओ 2 के गठन की गर्मी है। (जी) = -393.51 केजे, एच 2 ओ (जेडएच) = -285.84 केजे।
समाधान।अभिक्रिया का ज्ञात करने के लिए C 2 H 5 OH (Zh) के बनने की ऊष्मा जानना आवश्यक है। हम डेटा से उत्तरार्द्ध पाते हैं:
सी 2 एच 5 ओएच (डब्ल्यू) = सी 2 एच 5 ओएच (जी); = +42.36 केजे
42.36 = -235.31 - (सी 2 एच 5 ओएच (एफ))
ΔΗ (सी 2 एच 5 ओएच (एल)) = -235.31-42.36 = -277.67 केजे
हम हेस के नियम के परिणामों को लागू करते हुए प्रतिक्रिया के की गणना करते हैं:
एच.आर. = 2 (-393.51) + 3 (-285.84) + 277.67 = -1366.87 केजे।
अभिक्रिया का ऊष्मा प्रभाव 1366.87 kJ है।
ए) फे 2 ओ 3 (के) + 3 एच 2 (जी) = 2 एफई (के) + 3 एच 2 ओ (जी)
बी) Fe 2 O 3 (K) + 3CO (G) = 2Fe (K) + 3CO 2 (G)
किस स्थिति में इस प्रक्रिया में अधिक ऊर्जा की आवश्यकता होगी?
समाधान। XP की गणना करने के लिए, हम हेस के नियम से परिणाम के सूत्र और प्रत्येक पदार्थ के गठन की मानक एन्थैल्पी [परिशिष्ट 3] का उपयोग करते हैं:
a) = 2ΔΗ (Fe) + 3ΔΗ (H 2 O) - (ΔΗ (Fe 2 O 3) + 3ΔΗ (H 2)) = 2 (0) + 3 (-241.8) - ((-822 , 2 ) + 3 (0)) = -725.4 + 822.2 = 96.8 kJ।
ख) XP = 2ΔΗ (Fe) + 3ΔΗ (CO 2) - (ΔΗ (Fe 2 O 3) + 3ΔΗ (CO)) = 2 (0) + 3 (-393.5) - ((-822.2 ) + 3 ( -110.5)) = -1180.5 + 822.2 + 331.5 = -26.5 केजे।
गणना के अनुसार, प्रक्रिया a) - हाइड्रोजन के साथ आयरन (III) ऑक्साइड की कमी, प्रक्रिया b की तुलना में अधिक ऊर्जा खपत की आवश्यकता होती है)। प्रक्रिया बी में), प्रतिक्रिया एक्ज़ोथिर्मिक भी है (ऊर्जा गर्मी के रूप में जारी की जाती है)।
उदाहरण 3.जल गैस हाइड्रोजन और कार्बन मोनोऑक्साइड (II) के बराबर आयतन का मिश्रण है। 112 लीटर जल गैस, (सं.) को जलाने पर निकलने वाली ऊष्मा की मात्रा ज्ञात कीजिए।
समाधान।आइए प्रक्रिया के थर्मोकेमिकल समीकरण की रचना करें:
2 (Г) + СО (Г) + О 2 (Г) = 2 (Г) + 2 (Г) = - Q.
आइए हम ΔΗ XP की गणना करें जब 2 मोल जल गैस जल जाती है (H 2 का 1 मोल और CO का th मोल), अर्थात। 22.4 एल / मोल 2 मोल = 44.8 एल। गणना हेस के नियम के परिणाम के सूत्र और प्रत्येक पदार्थ के गठन के मानक थैलेपी के अनुसार की जाती है [जोड़ें। 3]:
= ΔΗ (Н 2 ) + ΔΗ (СО 2) - (ΔΗ (Н 2) + ΔΗ (СО) + ΔΗ (О 2)) = -241.8 - 393.5 - (0 - 110.5 + 0) = - 635.3 + 110.5 = - 524.8 kJ
हम अनुपात बनाते हैं:
44.8 लीटर जल गैस जलती है - 524.8 kJ ऊष्मा निकलती है
112 एल - एक्स केजे
एक्स = 112 524.8 / 44.8 = 1312 केजे
जब 112 लीटर पानी की गैस को जलाया जाता है, तो 1312 kJ ऊष्मा निकलती है।
उदाहरण 4.योजना के अनुसार प्रक्रिया Ga + HCl) GaCl 3 (t) + H 2 (g) की थर्मोडायनामिक विशेषताओं को दें:
1. स्टोइकोमेट्रिक समीकरण लिखिए।
2. शामिल पदार्थों के थर्मोडायनामिक कार्यों को लिखिए।
3. रासायनिक अभिक्रिया की मानक एन्थैल्पी में परिवर्तन की गणना कीजिए तथा एन्थैल्पी आरेख बनाइए।
4. निर्धारित करें कि क्या प्रतिक्रिया एक्सो- या एंडोथर्मिक है; इस प्रतिक्रिया के परिणामस्वरूप सिस्टम में तापमान बढ़ता या घटता है।
5. प्रतिक्रिया की मानक एन्ट्रापी में परिवर्तन की गणना करें, प्रतिक्रिया के दौरान एन्ट्रापी में परिवर्तन की व्याख्या करें।
6. संतुलन समीकरण और गिब्स समीकरण का उपयोग करके गिब्स ऊर्जा में मानक परिवर्तन की गणना करें। प्राप्त आंकड़ों का विश्लेषण दें।
7. मात्राओं के संकेतों की तुलना करें  ... तथा
... तथा  प्रतिक्रिया की उत्क्रमणीयता के बारे में निष्कर्ष निकालें।
प्रतिक्रिया की उत्क्रमणीयता के बारे में निष्कर्ष निकालें।
8. एक उत्क्रमणीय प्रतिक्रिया के लिए, गिब्स समीकरण के अनुसार संतुलन तापमान की गणना करें, यह मानते हुए कि अधिकतम स्वीकार्य तापमान 3000 K है। एक निष्कर्ष निकालें: Tr - प्राप्य या प्राप्य नहीं है।
9. मूल्य की गणना करें  तीन तापमानों (500, 1000 और 1500 K) पर। एक ग्राफिकल निर्भरता बनाएँ
तीन तापमानों (500, 1000 और 1500 K) पर। एक ग्राफिकल निर्भरता बनाएँ  ..
..
10. रासायनिक प्रतिक्रिया के सहज प्रवाह के बारे में निष्कर्ष निकालें। उन स्थितियों का निर्धारण करें जिनके तहत प्रतिक्रिया संभव है
समाधान।
1 स्टोइकोमेट्रिक समीकरण लिखिए।
2. हम प्रतिक्रिया घटकों (तालिका 21) के गठन के मानक थर्मोडायनामिक कार्यों को लिखते हैं (पदार्थों के थर्मोडायनामिक पैरामीटर [परिशिष्ट 3] से)।