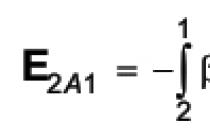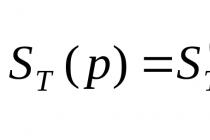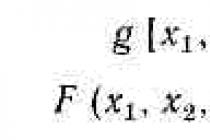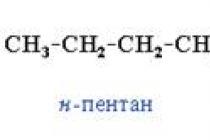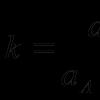Реакції органічних речовин можна формально розділити на чотири основні типи: заміщення, приєднання, відщеплення (елімінування) та перегрупування (ізомеризації). Очевидно, що все різноманіття реакцій органічних сполук неможливо звести до рамок запропонованої класифікації (наприклад, реакції горіння). Однак така класифікація допоможе встановити аналогії з вже знайомими вам із курсу неорганічної хімії класифікаціями реакцій, що протікають між неорганічними речовинами.
Як правило, основну органічну сполуку, яка бере участь у реакції, називають субстратом, а інший компонент реакції умовно розглядають як реагент.
Реакції заміщення
Реакції, у яких здійснюється заміна одного атома чи групи атомів у вихідної молекулі (субстраті) інші атоми чи групи атомів, називаються реакціями заміщення.
В реакції заміщення вступають граничні та ароматичні сполуки, такі, як, наприклад, алкани, циклоалкани або арени.
Наведемо приклади таких реакцій.
Під дією світла атоми водню в молекулі метану здатні заміщатися на атоми галогену, наприклад, на атоми хлору:
СН4 + Сl2→ СН3Сl + НСl
Іншим прикладом заміщення водню на галоген є перетворення бензолу на бромбензол:
При цій формі запис реагенти, каталізатор, умови проведення реакції записують над стрілкою, а неорганічні продукти реакції - під нею.
Реакції приєднання
Реакції, у яких дві чи більше молекул реагуючих речовин з'єднуються в одну, називають реакціями приєднання.
В реакції приєднання вступають ненасичені сполуки, такі як, наприклад, алкени або алкіни. Залежно від того, яка молекула виступає як реагент, розрізняють гідрування (або відновлення), галогенування, гідрогалогенування, гідратацію та інші реакції приєднання. Кожна з них потребує певних умов.
1 . Гідрування - реакція приєднання молекули водню щодо кратного зв'язку:
СН3-СН = СН2 + Н2 → СН3-СН2-СН3
пропен пропан
2 . Гідрогалогенування - реакція приєднання галогеноводороду (наприклад, гідрохлорування):
СН2 = СН2 + НСl → СН3-СН2-Сl
етен хлоретан
3 . Галогенування - реакція приєднання галогену (наприклад, хлорування):
СН2 = СН2 + Сl2 → СН2Сl-СН2Сl
етен 1,2-дихлоретан
4 . Полімеризація - особливий тип реакцій приєднання, в ході яких молекули речовини з невеликою молекулярною масою з'єднуються одна з одною з утворенням молекул речовини з дуже високою молекулярною масою - макромолекул.
Реакції полімеризації - це процеси з'єднання безлічі молекул низькомолекулярної речовини (мономіра) у великі молекули (макромолекули) полімеру.
Прикладом реакції полімеризації може бути отримання поліетилену з етилену (етену) під дією ультрафіолетового випромінювання і ініціатора радикального полімеризації R.
Типи хімічних реакцій в органічній хімії
Реакції відщеплення (елімінування)
Реакції, у яких з молекули вихідного сполуки утворюються молекули кількох нових речовин, називають реакціями відщеплення чи елімінування.
Прикладами таких реакцій може бути отримання етилену з різних органічних речовин.

Типи хімічних реакцій в органічній хімії
Особливе значення серед реакцій відщеплення має реакція термічного розщеплення вуглеводнів, на якому заснований крекінг (англ. to crack – розщеплювати) алканів – найважливіший технологічний процес:

У більшості випадків відщеплення малої молекули від молекули вихідної речовини призводить до утворення додаткового зв'язку між атомами. Реакції елімінування протікають у певних умовах та з певними реагентами. Наведені рівняння відбивають лише кінцевий результат цих перетворень.
Реакції ізомеризації
Реакції, у яких з молекул однієї речовини утворюються молекули, інших речовин тієї самої якісного і кількісного складу, т. е. з тієї ж молекулярної формулою, називають реакціями ізомеризації.
Прикладом такої реакції є ізомеризація вуглецевого скелета алканів лінійної будови в розгалужені, яка відбувається на хлориді алюмінію за високої температури:
Типи хімічних реакцій в органічній хімії
1 . До якого типу реакцій належить:
а) одержання хлорметану з метану;
б) одержання бромбензолу з бензолу;
в) одержання хлоретану з етилену;
г) одержання етилену з етанолу;
д) перетворення бутану на ізобутан;
е) дегідрування етану;
ж) перетворення брометана на етанол?
2 . Які реакції характерні для: а) алканів; б) алкенів? Наведіть приклади реакцій.
3 . У чому особливості реакцій ізомеризації? Що їх поєднує з реакціями отримання алотропних модифікацій одного хімічного елемента? Наведіть приклади.
4. В яких реакціях (приєднання, заміщення, елімінування, ізомеризація) молекулярна маса вихідної сполуки:
а) збільшується;
б) зменшується;
в) не змінюється;
г) залежно від реагенту збільшується чи зменшується?
Нуклеофільноїназивається реакція, за якої реагент атакує субстрат своїм нуклеофілом; вона позначається індексом N (Nucleophlle).
У електрофільних реакціях реагент називається електрофілом. В органічній хімії електрофільність реагенту характеризує його здатність взаємодіяти з атомом вуглецю субстрату, який несе повний або частковий негативний заряд.
Насправді механізм і результат будь-якої електрофільно-нуклеофільної реакції визначається як властивостями реагенту, а й властивостями субстрату, продуктів реакції, розчинника і умовами її проведення. Тому поділ електрофільно-нуклеофільних реакцій на нуклеофільні та електрофільні лише за властивостями реагенту має умовний характер. Крім того, як видно з наведених схем, у цих реакціях завжди взаємодіють між собою електрофіли та нуклеофіли, що містяться в субстраті та реагенті. Багато реакціях лише умовно один компонент може вважатися субстратом, а інший – реагентом.
Вільнорадикальні реакції.Гомолітичний розпад характерний для неполярного чи малополярного зв'язку. Він супроводжується утворенням вільних радикалів – частинок із неспареним електроном.
Гомоліз ковалентного зв'язку можна розглядати як розщеплення зв'язку по обмінному механізму. Для здійснення гомолізу зв'язку потрібна енергія (теплота, світло), достатня для того, щоб розірвати цей зв'язок. Наявність неспареного електрона є причиною малої стабільності вільних радикалів (час життя в більшості випадків становить частки секунди) і високої реакційної здатності в вільнорадикальні реакції.Присутність у системі вільного радикала (R?) може призводити до утворення нових радикалів внаслідок його взаємодії з наявними молекулами: R? + А – В → R – A +?
Вільнорадикальні реакціїсупроводжуються взаємодією вільних радикалів з молекулами або між собою з утворенням нових вільних радикалів (зародження чи розвиток ланцюга) або лише молекул (обрив ланцюга).
Для вільнорадикальних реакцій характерний ланцюговий механізм, який включає три стадії: зародження, розвиток та обрив ланцюга. Ці реакції припиняються при зникненні у системі вільних радикалів. Вільнорадикальні реакції позначаються індексом R (Радичний).
Радикальні частки залежно від їх спорідненості до електрона можуть приймати електрони (тобто бути окислювачами), і віддавати електрони (тобто бути відновниками). У цьому спорідненість радикала до електрона визначається як його властивостями, а й властивостями його партнера з реакції. Особливості процесів вільнорадикального окислення-відновлення, що протікають в організмі, розглядаються окремо при описі властивостей певних класів органічних сполук.
У реакціях комплексоутворення радикалами може бути і комплексоутворювач, і лиганды. У разі комплексів із перенесенням заряду радикалоутворення може відбуватися всередині комплексу за рахунок внутрішньомолекулярного окислення-відновлення між комплексоутворювачем та лігандом.
Утворення радикалів найлегше відбувається при гомолізі неполярних простих зв'язків між атомами того самого елемента:
С1 2 → С1۰ + ۰С1 НО-ОН → НО۰ + ۰ОН
R-О-О-R" → RO۰ + ۰OR" R-S-S-R" →RS۰ + ۰SR"
При гомоліз малополярного зв'язку С-Н утворюються алкільні радикали, в яких неспарений електрон знаходиться у атома вуглецю. Відносна стійкість цих радикалів залежить від типу заміщення атома вуглецю, що несе неспарений електрон, і зростає в ряду: СН 3< CH 2 R < CHR 2 < CR 3 . Это объясняется положительным индуктивным эффектом алкильных групп, который, повышая электронную плотность на атоме углерода, способствует стабилизации радикала.
Стабільність вільних радикалів істотно зростає, коли є можливість ділалізації неспареного електрона за рахунок π-електронів сусідніх кратних зв'язків. Це особливо наочно спостерігається в алільному та бензильному радикалах:
 |
алільний радикал бензильний радикал
У ході ознайомлення з можливими механізмами реакцій у молекулах субстрату та реагенту слід розрізняти реакційні центри за їх характером: нуклеофільні, електрофілніі радикальні.
За кінцевим результатом хімічного перетворення найпростіші органічні реакції класифікуються на реакції: заміщення, приєднання, елімінування (відщеплення)і перегрупування.
Реакція заміщення.Під заміщенням розуміють заміну атома чи групи на інший атом чи групу. У реакції заміщення завжди утворюються два різні продукти. Цей тип реакцій позначається символом S (Substitution).
До реакцій заміщення відносяться: галогенування та нітрування алканів, етерифікація та алкілування карбонових кислот, а також численні реакції взаємодії простих полярних молекул (Н2О, NH3, НГал) з ефірами, спиртами та галогенпохідними.
Реакція приєднання.Під приєднанням розуміють введення атомів або груп у молекулу ненасиченої сполуки, що супроводжується розривом π-зв'язків. При цьому подвійні зв'язки перетворюються на ординарні, а потрійні зв'язки - на подвійні або ординарні. Цей тип реакцій позначається символом A (Addition).
Реакції елімінування (відщеплення).Під елімінуванням розуміють відщеплення атомів чи груп від органічної молекули з утворенням кратного зв'язку. Тому реакції елімінування обернені реакцій приєднання. Цей тип реакції позначається символом Е (Elimination).
Кожна з органічних реакцій заміщення (S), приєднання (А) або елімінування (Е) може бути електрофільною (Е), нуклеофільною (N) або радикальною (R). Таким чином, органічної хімії виділяють дев'ять типових реакцій, що позначаються символами S, А або Е з індексами R, N або Е:
Наведені типи органічних реакцій слід вважати модельними, оскільки де вони завжди реалізуються у вигляді. Так, наприклад, заміщення та елімінування можуть протікати одночасно:
При подальшому знайомстві з конкретними класами органічних сполук нами розглядатимуться такі їх хімічні властивості: кислотно-основні, комплексоутворювальні, окислювально-відновлювальні, електрофільно-нуклеофільні, а також здатність до вільнорадикальної взаємодії. Особливу увагу буде приділено особливостям перебігу реакцій, що розглядаються в біологічних системах.
Типи реакцій, характерні для різних класів вуглеводнів, механізм їх перебігу та біологічне значення процесів представлені у таблиці 10.
 |
Існують різні системи класифікації органічних реакцій, що ґрунтуються на різних ознаках. Серед них можна виділити класифікацію:
- по кінцевого результату реакції, тобто зміни у структурі субстрату;
- по механізму протікання реакції, тобто за типом розриву зв'язків та типом реагентів.
Взаємодіючі в органічній реакції речовини поділяють на реагенті субстрат. При цьому вважають, що реагент атакує субстрат.
ВИЗНАЧЕННЯ
Реагент- Речовина, що діє на об'єкт - субстрат - і зміна хімічного зв'язку, що викликає в ньому. Реагенти поділяються на радикальні, електрофільні та нуклеофільні.
ВИЗНАЧЕННЯ
Субстратомзазвичай вважають молекулу, яка надає атом вуглецю для нового зв'язку.
КЛАСИФІКАЦІЯ РЕАКЦІЙ З КІНЦЕВОГО РЕЗУЛЬТАТУ (ЗМІНА В СТРУКТУРІ СУБСТРАТУ)
В органічній хімії розрізняють чотири види реакцій за кінцевим результатом та зміною в структурі субстрату: приєднання, заміщення, відщеплення,або елімінування(Від англ. to eliminate- видаляти, відщеплювати), та перегрупування (ізомеризації). Така класифікація аналогічна класифікації реакцій у неорганічній хімії за кількістю вихідних реагентів і речовин, що утворюються, зі зміною або без зміни складу. Класифікація за кінцевим результатом полягає в формальних ознаках, оскільки стехиометрическое рівняння, зазвичай, не відбиває механізм реакції. Порівняємо типи реакцій у неорганічній та органічній хімії.
Тип реакції у неорганічній хімії | приклад | Тип реакції в органічній хімії | Різновид і приклад Реакції |
|---|---|---|---|
1. З'єднання | C l2 + H2 = 2 H C l | Приєднання до кратних зв'язків | Гідрування |
Гідрогалогенування
|
|||
Галогенування
|
|||
Гідратація
|
|||
2. Розкладання | 2
H2
O = 2 H2
+
O2
| Елімінування | Дегідрування
|
Дегідрогалогенування
|
|||
Дегалогенування
|
|||
Дегідратація
|
|||
3. Заміщення | Z n + 2 H C l =ZnCl2+H2 | Заміщення |
|
4. Обмін (частковий випадок – нейтралізація) | H2 S O4 + 2 N a O H=N a 2 S O 4 + 2 H 2 O | окремий випадок - етерифікація |
|
5.Алотропізація | графіт ⇔ алмаз Pчервоний.⇔ Pбіл. Pкрасн.⇔P біл. Sромб.⇔ Sпласт. Sромб.⇔Sпласт. | Ізомеризація | Ізомеризація алканів
|
д) без заміни їх іншими.
Залежно від того, які атоми відщеплюються – сусідні C–Cабо ізольовані двома-трьома або більше атомами вуглецю – C-C-C- C–, –C-C-C-C- C–, можуть утворюватися з'єднання з кратними зв'язкамиі або циклічні сполуки. Відщеплення галогеноводородів з алкилгалогенидов чи води зі спиртів відбувається за правилом Зайцева.
ВИЗНАЧЕННЯ
Правило Зайцева: атом водню Н відщеплюється від найменш гідрогенізованого атома вуглецю
Наприклад, відщеплення молекули бромоводню походить від сусідніх атомів у присутності лугу, при цьому утворюється бромід натрію та вода.
ВИЗНАЧЕННЯ
Перегрупування- хімічна реакція, внаслідок якої відбувається зміна взаємного розташування атомів у молекулі, переміщення кратних зв'язків або зміна їхньої кратності.
Перегрупування може здійснюватися зі збереженням атомного складу молекули (ізомеризація) або його зміною.
ВИЗНАЧЕННЯ
Ізомеризація- окремий випадок реакції перегрупування, що призводить до перетворення хімічної сполуки на ізомер шляхом структурної зміни вуглецевого скелета.
Перегрупування також може здійснюватися за гомолітичним або гетеролітичним механізмом. Молекулярні перегрупування можуть класифікуватися за різними ознаками, наприклад, за насиченістю систем, за природою мігруючої групи, за стереоспецифічністю та ін. Багато реакцій перегрупування мають специфічні назви - перегрупування Кляйзена, перегрупування Бекмана та ін.
Реакції ізомеризації широко використовуються у промислових процесах, наприклад, при переробці нафти для підвищення октанового числа бензину. Прикладом ізомеризації є перетворення н-октану в ізооктан:
КЛАСИФІКАЦІЯ ОРГАНІЧНИХ РЕАКЦІЙ ЗА ТИПОМ РЕАГЕНТА
РОЗРИВ ЗВ'ЯЗКУ
Розрив зв'язку в органічних сполуках може бути гомолітичним і гетеролітичним. 
ВИЗНАЧЕННЯ
Гомолітичний розрив зв'язку- це такий розрив, в результаті якого кожен атом отримує неспарений електрон і утворюються дві частинки, що мають подібну електронну будову. радикали.
Гомолітичний розрив характерний для неполярних чи слабополярнихзв'язків, наприклад C–C, Cl–Cl, C–H, і потребує великої кількості енергії.
Радикали, що утворюються, мають неспарений електрон, мають високу реакційну здатність, тому хімічні процеси, що протікають за участю таких частинок, часто носять «ланцюговий» характер, їх важко контролювати, а в результаті реакції виходить набір продуктів заміщення. Так, при хлоруванні метану продуктами заміщення є хлорметан. C H3 C l CH3Cl, дихлорметан C H2 C l2 CH2Cl2, хлороформ C H C l3 CHCl3та чотирихлористий вуглець C C l4 CCl4. Реакції за участю вільних радикалів протікають обмінним механізмом утворення хімічних зв'язків.
Радикали, що утворюються в ході такого розриву зв'язку, зумовлюють радикальний механізмпротікання реакції. Радикальні реакції зазвичай протікають при підвищених температурах або випромінюванні (наприклад, світло).
Через свою високу реакційну здатність вільні радикали можуть негативно впливати на організм людини, руйнуючи клітинні мембрани, впливаючи на ДНК і викликаючи передчасне старіння. Ці процеси пов'язані, насамперед, з пероксидним окисленням ліпідів, тобто руйнуванням структури поліненасичених кислот, що утворюють жир усередині клітинної мембрани.
ВИЗНАЧЕННЯ
Гетеролітичний розрив зв'язку- це такий розрив, при якому електронна пара залишається у більш електронегативного атома і утворюються дві заряджені частки - іони: катіон (позитивний) та аніон (негативний).
У хімічних реакціях ці частинки виконують функції. нуклеофілів»(«філ» - від гр. кохати) та « електрофілів», утворюючи хімічний зв'язок з партнером щодо реакції з донорно-акцепторного механізму. Частинки-нуклеофіли надають електронну пару для створення нового зв'язку. Іншими словами,
ВИЗНАЧЕННЯ
Нуклеофіл- електронадлишковий хімічний реагент, здатний взаємодіяти з електронодефіцитними сполуками.
Прикладами нуклеофілів є будь-які аніони ( C l− , I− , N O− 3 Cl−,I−,NO3−та ін), а також з'єднання, що мають неподілену електронну пару ( N H3 , H2 O NH3,H2O).
Таким чином, при розриві зв'язку можуть утворитися радикали або нуклеофіли та електрофіли. Тому виділяють три механізми протікання органічних реакцій.
МЕХАНІЗМИ ПРОТЕКУВАННЯ ОРГАНІЧНИХ РЕАКЦІЙ
Вільно-радикальний механізм: реакцію починають вільні радикали, що утворюються при гомолітичному розривізв'язки у молекулі.
Найбільш типовий варіант – утворення радикалів хлору або брому при УФ-опроміненні.
1. Вільно-радикальне заміщення

метан бромметан
Ініціювання ланцюга

Зростання ланцюга
Обрив ланцюга
2. Вільно-радикальне приєднання
етен поліетилен
Електрофільний механізм: реакцію починають частинки-електрофіли, що отримують позитивний заряд в результаті гетеролітичного розривузв'язку. Усі електрофіли - кислоти Льюїса.
Такі частки активно утворюються під дією кислот Льюїса, які посилюють позитивний заряд частки Найчастіше використовуються A l C l3 , F e C l3 , F e B r3 , Z n C l2 AlCl3, FeCl3, FeBr3, ZnCl2виконують функції каталізатора.
Місцем атаки частинки-електрофіла є ті ділянки молекули, які мають підвищену електронну щільність, тобто кратний зв'язок та бензольне кільце.
Загальний вид реакцій електрофільного заміщення можна виразити рівнянням:
1. Електрофільне заміщення

бензол бромбензол
2. Електрофільне приєднання
пропен 2-бромпропан
пропін 1,2-дихлорпропен
Приєднання до несиметричних ненасичених вуглеводнів відбувається відповідно до правила Марковникова.
ВИЗНАЧЕННЯ
Правило Марковнікова:приєднання до несиметричних алкенів молекул складних речовин з умовною формулою НХ (де Х - це атом галогену або гідроксильна група ВІН) атом водню приєднується до найбільш гідрогенізованого (що містить найбільше атомів водню) атома вуглецю при подвійному зв'язку, а Х - до найменш гідрогенізованого.
Наприклад, приєднання хлороводню HCl до молекули пропена C H3 - C H = C H2 CH3–CH=CH2.

Реакція протікає механізмом електрофільного приєднання. За рахунок електронодонорного впливу C H3 CH3-групи електронна щільність у молекулі субстрату зміщена до центрального атома вуглецю (індуктивний ефект), а потім за системою подвійних зв'язків - до кінцевого атома вуглецю C H2 CH2-групи (мезомірний ефект) Таким чином, надмірний негативний заряд локалізовано саме на цьому атомі. Тому атаку починає протон водню H+ H+є електрофільною частинкою. Утворюється позитивно заряджений карбеновий іон [C H3 – C H − C H3 ] + + , до якого приєднується аніон хлору C l− Cl−.
ВИЗНАЧЕННЯ
Винятки із правила Марковникова:реакція приєднання протікає проти правила Марковникова, якщо реакцію вступають сполуки, у яких атом вуглецю, сусідній з атомом вуглецю подвійного зв'язку, відтягує він частково електронну щільність, тобто за наявності заступників, виявляють значний электроноакцепторный ефект (– C C l3 , – C N , – C O O H(-CCl3,-CN,-COOHта ін.).

Нуклеофільний механізм: реакцію починають частинки-нуклеофіли, що мають негативний заряд, що утворилися в результаті. гетеролітичного розривузв'язку. Усі нуклеофіли - підстави Льюїса.
У нуклеофільних реакціях реагент (нуклеофіл) має на одному з атомів вільну пару електронів і є нейтральною молекулою або аніоном ( H a l– , O H– , R O− , R S– , R C O O– , R– , C N – , H2 O, R O H, N H3 , R N H2 Hal-,OH-,RO-,RS-,RCOO-,R-,CN-,H2O,ROH,NH3,RNH2та ін.).
Нуклеофіл атакує в субстраті атом із найменшою електронною щільністю (тобто з частковим або повним позитивним зарядом). Першою стадією реакції нуклеофільного заміщення є іонізація субстрату з утворенням карбкатіону. При цьому новий зв'язок утворюється за рахунок електронної пари нуклеофіла, а стара зазнає гетеролітичного розриву з подальшим відщепленням катіону. Прикладом нуклеофільної реакції може бути нуклеофільне заміщення (символ SN SN) у насиченого атома вуглецю, наприклад лужний гідроліз бромпохідних.
1. Нуклеофільне заміщення
2. Нуклеофільне приєднання

етаналь ціангідрин
джерело http://foxford.ru/wiki/himiya
У ході реакції в молекулах реагуючих речовин розриваються одні хімічні зв'язки та утворюються інші. Органічні реакції класифікуються за типом розриву хімічних зв'язків у частинках, що реагують. З-поміж них можна виділити дві великі групи реакцій - радикальні та іонні.
Радикальні реакції - це процеси, що йдуть із гомолітичним розривом ковалентного зв'язку. При гомолітичному розриві пари електронів, що утворює зв'язок, ділиться таким чином, що кожна з частинок, що утворюються, отримує по одному електрону. Внаслідок гомолітичного розриву утворюються вільні радикали:
Нейтральний атом чи частка з неспареним електроном називається вільним радикалом.
Іонні реакції - це процеси, що йдуть з гетеролітичним розривом ковалентних зв'язків, коли обидва електрони зв'язку залишаються з однією з раніше зв'язаних частинок:
В результаті гетеролітичного розриву зв'язку виходять заряджені частинки: нуклеофільна та електрофільна.
Нуклеофільна частка (нуклеофіл) – це частка, що має пару електронів на зовнішньому електронному рівні. За рахунок пари електронів нуклеофіл здатний утворювати новий ковалентний зв'язок.
Електрофільна частка (електрофіл) – це частка, що має незаповнений зовнішній електронний рівень. Електрофіл представляє незаповнені, вакантні орбіталі для утворення ковалентного зв'язку за рахунок електронів тієї частки, з якою він взаємодіє.
В органічній хімії всі структурні зміни розглядаються щодо атома (або атомів) вуглецю, що бере участь у реакції.
Відповідно до вищевикладеного хлорування метану під дією світла класифікують як радикальне заміщення, приєднання галогенів до алкенів - як електрофільне приєднання, а гідроліз алкілгалогенідів - як нуклеофільне заміщення.
Найчастіше зустрічаються такі типи оеакций.
Основні типи хімічних реакцій
I. Реакції заміщення(Заміна одного або декількох атомів водню на атоми галогенів або спецгрупу) RCH 2 X + Y → RCH 2 Y + X
ІІ. Реакції приєднання RCH = CH 2 + XY → RCHX-CH 2 Y
ІІІ. Реакції відщеплення (елімінування) RCHX-CH 2 Y → RCH = CH 2 + XY
IV. Реакції ізомеризації (перегрупування)
V. Реакції окиснення(взаємодія з киснем повітря чи окислювача)
У цих перерахованих типах реакції розрізняють ще й спеціалізованіі іменніреакції.
Спеціалізовані:
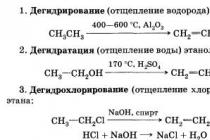
1) гідрування (взаємодія з воднем)
2) дегідрування (відщеплення від молекули водню)
3) галогенування (взаємодія з галогеном: F 2 , Cl 2 , Br 2 , I 2)
4) дегалогенування (відщеплення від молекули галогену)
5) гідрогалогенування (взаємодія з галогенводнем)
6) дегідрогалогенування (відщеплення від молекули галогенводню)
7) гідратація (взаємодія з водою у незворотній реакції)
8) дегідратація (відщеплення від молекули води)
9) гідроліз (взаємодія з водою у оборотній реакції)
10) полімеризація (отримання багаторазового збільшеного вуглецевого скелета з однакових простих сполук)
11) поліконденсація (отримання багаторазового збільшеного вуглецевого скелета з двох різних сполук)
12) сульфування (взаємодія із сірчаною кислотою)
13) нітрування (взаємодія з азотною кислотою)
14) крекінг (зменшення вуглецевого скелета)
15) піроліз (розкладання складних органічних речовин більш прості під впливом високих температур)
16) реакція алкілування (введення у формулу радикалу алкану)
17) реакція ацилювання (введення у формулу групи -C(CH 3)O)
18) реакція ароматизації (освіта вуглеводню ряду аренів)
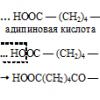
19) реакція декарбоксилювання (відщеплення від молекули карбоксильної групи-COOH)
20) реакція етерифікації (взаємодія спирту з кислотою або отримання складного ефіру зі спирту або карбонової кислоти)
21) реакція «срібного дзеркала» (взаємодія з розчином аміаку оксиду срібла (I))
Іменні реакції:
1) реакція Вюрца (подовження вуглецевого скелета при взаємодії галогенпохідного вуглеводню з активним металом)
2) реакція Кучерова (отримання альдегіду при взаємодії ацетилену з водою)
3) реакція Коновалова (взаємодія алкану з розведеною азотною кислотою)
4) реакція Вагнера (окислення вуглеводнів з подвійним зв'язком киснем окислювача в слаболужному або нейтральному середовищі за нормальних умов)
5) реакція Лебедєва (дегідрування та дегідратація спиртів при отриманні алкадієнів)
6) реакція Фріделя-Крафтса (реакція алкілування арена хлоралканом при отриманні гомологів бензолу)
7) реакція Зелінського (отримання бензолу з циклогексану дегідруванням)
8) реакція Кірхгофа (перетворення крохмалю в глюкозу при каталітичній дії сірчаної кислоти)