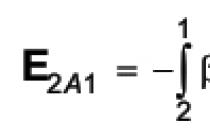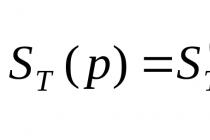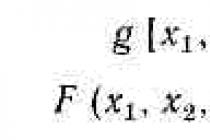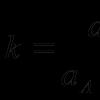Федеральне агентство з освіти
Ангарська державна технічна академія
Кафедра хімії
Курсова робота
з дисципліни «Хімія»
Тема:
Визначення термодинамічної можливості
протікання хімічних процесів у реакції:
Виконавець: *********.
студентка групи ЕУП-08-10
Керівник:
доцент кафедри хімії
Кузнєцова Т.А.
Ангарськ 2009
Завдання до курсової роботи
1. Навести фізико-хімічну характеристику всіх учасників реакції та способів їх одержання.
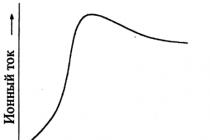
4. Визначити можливість перебігу реакції H 2+ Cl 2=2 HClза стандартних умов та за температури = 1000 До.
5. Використовуючи метод Темкіна-Шварцмана розрахувати
при температурі = 1200 =1500. Побудувавши залежність графічно визначити температуру, коли він процес можливий, як мимовільний у напрямі. = 1200 =1500.
1. Теоретична частина
1.1 Етанол та його властивості
Етанол - Безбарвна рухлива рідина з характерним запахом і пекучим смаком.
Таблиця 1. Фізичні властивості етанолу
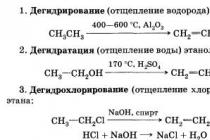
Змішується з водою, ефіром, ацетоном та багатьма іншими органічними розчинниками; легко спалахує; з повітрям етанол утворює вибухонебезпечні суміші (3,28-18,95% за обсягом). Етанол має всі характерні для одноатомних спиртів хімічні властивості, наприклад з лужними та лужноземельними металами утворює алкоголяти, з кислотами – складні ефіри, при окисленні етанолу – ацетальдегід, при дегідратації – етилен та етиловий ефір. При хлоруванні етанолу утворюється хлораль.
1.2 Способи одержання етанолу
Існує 2 основних способи отримання етанолу - мікробіологічний ( бродінняі гідроліз) та синтетичний:
Бродіння
Відомий з давніх-давен спосіб отримання етанолу - спиртове бродіння органічних продуктів, що містять цукор (буряк і т. п.). Аналогічно виглядає переробка крохмалю, картоплі, рису, кукурудзи, деревини та ін під дією ферменту зимази. Ця реакція досить складна, її схему можна виразити рівнянням:
C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2
В результаті бродіння виходить розчин, що містить не більше 15% етанолу, так як у концентрованих розчинах дріжджі зазвичай гинуть. Отриманий таким чином етанол потребує очищення та концентрування, зазвичай шляхом дистиляції.
Промислове виробництво спирту з біологічної сировини
· Винокурні заводи
· Гідролізне виробництво
Для гідролізного виробництва застосовується сировина, що містить целюлозу – деревина, солома.
· Відходами бродильного виробництва є барда та сивушні олії
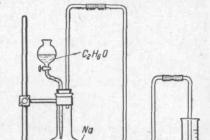
Гідратація етилену
У промисловості, поряд із першим способом, використовують гідратацію етилену. Гідратацію можна вести за двома схемами:
· пряма гідратація при температурі 300 °C, тиску 7 МПа, як каталізатор застосовують ортофосфорну кислоту, нанесену на силікагель, активоване вугілля або азбест:
CH 2 =CH 2 + H 2 O → C 2 H 5 OH
· гідратація через стадію проміжного ефіру сірчаної кислоти, з наступним його гідролізом (при температурі 80-90 ° С та тиску 3,5 МПа):
CH 2 =CH 2 + H 2 SO 4 → CH 3 -CH 2 -OSO 2 OH (етилсерна кислота)
CH 3 -CH 2 -OSO 2 OH + H 2 O → C 2 H 5 OH + H 2 SO 4
Ця реакція ускладнюється утворенням діетилового ефіру.
Очищення етанолу
Етанол, отриманий шляхом гідратації етилену або бродінням, є водно-спиртову суміш, що містить домішки. Для його промислового, харчового та фармакопейного застосування необхідне очищення. Фракційна перегонка дозволяє отримати етанол з концентрацією близько 95.6% об.; ця нероздільна перегонкою азеотропна суміш містить 4.4 % води (ваг.) і має температуру кипіння 78.2 °C.
Перегонка звільняє етанол як легколетких, і від важких фракцій органічних речовин (кубовий залишок).
Абсолютний спирт
Абсолютний спирт - етиловий спирт, що практично не містить води. Кипіння при температурі 78,39 °C, тоді як спирт спирт-ректифікат, що містить не менше 4,43 % води, кипить при температурі 78,15 °C. Отримують перегонкою водного спирту, що містить бензол, та іншими способами.
1.3 Застосування
Паливо
Етанол може використовуватися як паливо (у т. ч. для ракетних двигунів, двигунів внутрішнього згоряння).
Хімічна промисловість
· Служить сировиною для отримання багатьох хімічних речовин, таких як ацетальдегід, діетиловий ефір, тетраетилсвинець, оцтова кислота, хлороформ, етилацетат, етилен та ін;
· Широко застосовується як розчинник (у барвистій промисловості, у виробництві товарів побутової хімії та багатьох інших областях);
· Є компонентом антифризу.
Медицина
Етиловий спирт насамперед використовується як антисептик
· як знезаражуюче та підсушує засобів, зовнішньо;
· Розчинник для лікарських засобів, для приготування настоянок, екстрактів з рослинної сировини та ін;
· Консервант настоянок та екстрактів (мінімальна концентрація 18%)
Парфумерія і косметика
Є універсальним розчинником різних запашних речовин та основним компонентом парфумів, одеколонів тощо. Входить до складу різноманітних лосьйонів.
Харчова промисловість
Поряд із водою, є необхідним компонентом спиртних напоїв (горілка, віскі, джин та ін.). Також у невеликих кількостях міститься у низці напоїв, одержуваних бродінням, але не зараховуються до алкогольних (кефір, квас, кумис, безалкогольне пиво та ін.). Вміст етанолу у свіжому кефірі мізерний (0,12 %), але в довгому, особливо в теплому місці, може досягти 1 %. У кумисі міститься 1-3% етанолу (у міцному до 4,5%), у квасі - від 0,6 до 2,2%. Розчинник для ароматизаторів харчових. Застосовується як консервант для хлібобулочних виробів, а також у кондитерській промисловості
1.4 Етилен. Фізичні та хімічні властивості
Етилен, H2C=CH2 – ненасичений вуглеводень, перший член гомологічного ряду олефінів, безбарвний газ із слабким ефірним запахом; практично нерозчинний у воді, погано – у спирті, краще – в ефірі, ацетоні. Горить слабокоптячим полум'ям, з повітрям утворює вибухонебезпечні суміші. Етилен дуже реакційноздатний.
Таблиця 2. Фізичні властивості етилену
Можливість мимовільного перебігу реакції;
Ентропія;
Ізобарно - ізотермічний потенціал чи вільна енергія Гіббса.
Мимовільниминазиваються процеси, в результаті яких може бути отримана корисна робота, мимовільниминазиваються процеси, куди треба витратити роботу.
Розглянемо два мимовільні процеси – розчинення гідроксиду натрію та розчинення нітрату амонію:
Це мимовільні процеси, але один із них супроводжується виділенням тепла, а інший – поглинанням тепла. Як бачимо, знак теплового ефекту процесу (ентальпійний фактор) не однозначно визначає можливість мимовільного перебігу процесу. Існує другий фактор мимовільності процесу - ентропійний фактор.
Що таке ентропія?
Стан будь-якої системи може бути описаний, з одного боку, за значенням вимірюваних параметрів системи (макростанів системи), з іншого боку, стан системи можна описати безліччю миттєвих мікростанів, яким відповідають різні енергетичні рівні мікрочастинок, що становлять нашу систему.
Число мікростанів, яке відповідає даному макростану речовини, називається термодинамічної ймовірністюйого стану (W), тобто W – це число способів, якими молекули можна розподілити за різними енергетичними рівнями.
З термодинамічної ймовірністю стану пов'язана функція стану системи, яка називається ентропією (S).
S = k ln W, де k – постійна Больцмана, k ≈ 1,38∙10 -23 Дж/K ,
W – термодинамічна ймовірність стану системи.
Для 1 моль речовини:
S = R ln W, де R - універсальна газова стала, тут S вимірюється в .
Ймовірність стану максимальнапри максимальній розпорядкованості системи, тобто ентропія максимальна тоді, коли система знаходиться в найбільш розпорядкованому стані. Саме цього система прагне мимоволі.
Будь-яка система прагне перейти у стан найбільшого безладдя, тобто мимоволі, кожна система прагне збільшення ентропії. І ентропія є мірою безладдя у системі. Вона збільшується у таких фізичних процесах, як плавлення, кипіння, розширення газів. У хімічних процесах ентропія збільшується, якщо вихідних речовин, взятих у твердому або рідкому станах, виходить газоподібні продукти реакції, або - якщо число молекул під час реакції збільшується.
Т. е. ентропія зростає, т. к. збільшується кількість частинок, що рухаються.
DS< 0 , - энтропия уменьшается т. к. уменьшается количество частиц (из 3-х в 2) и система переходит из газообразного состояния в жидкое.
Розглянемо зміну ентропії в системі при переході з одного стану, що характеризується об'ємом V 1 в інше - з об'ємом V 2:
Якщо V 2 > V 1 то DS > 0, якщо V 2< V 1 , то DS < 0, т.е. при увеличении объема энтропия увеличивается.
Ентропія ідеального кристала при абсолютному нулі дорівнює нулю, тому можна розрахувати абсолютне значення ентропії кожної речовини. У таблицях наводиться стандартне значення ентропії (S°) за стандартних умов.
Ентропія– функція стану речовини, отже, залежить від шляху переходу системи з одного стану до іншого. Для оборотних ізотермічних процесів ( фазових переходів), зміна ентропії дорівнює зміні ентальпії, поділеному на температуру:
Ентропія залежить від температури:
Де С Р – молярна теплоємність при постійному тиску.
Ентальпія речовин як властивість, пов'язана в основному з внутрішньою структурою молекул, практично не залежить від тиску, який зазвичай завжди набагато менше внутрішньомолекулярної взаємодії. Виняток становлять процеси, що проводяться при надвисокому тиску, наприклад, при синтезі алмазів. Тоді враховувати залежність ентальпії від тиску необхідно.
Тверді і рідкі тіла, що знаходяться в конденсованому стані через сильну міжмолекулярну взаємодію, практично не стискуються при розумних тисках. Тому член Р d Vу термодинамічних величинах для конденсованих тіл зазвичай малий. Це призводить до того, що для твердих та рідких тілможна не робити відмінностей між теплоємностями при постійному тиску та об'ємі між внутрішньою енергією та ентальпією
Через практичну стисливість можна вважати, що від тиску не залежить і ентропія S конденсованих тіл: через тиск всередину передається занадто мало додаткової енергії ( Р d V), порівняно з вже наявною у тіла через внутрішньомолекулярну та міжмолекулярну взаємодію.
Але для газів, де міжмолекулярна взаємодія дуже мала , Ентропія істотно залежить від тиску та об'єму системи. Справді, розглянемо процес ізотермічної зміни тиску від початкового значення р 0 до деякого рз одночасною зміною обсягу. Тоді для роботи, виконаної над тілом, з використанням рівняння стану ідеального газу ( PV=RT) Отримаємо:
Оскільки розглядається ізотермічний процес, то зміни внутрішньої енергії Uв системі не відбувається: тепло, що виділилося або поглинулося, буде віддано або отримано з навколишнього середовища, що і компенсує тимчасову зміну внутрішньої енергії. Отже, сума отриманих робіт і тепла дорівнює нулю:
T.e. абсолютне значення ентропії газу при тиску, що відрізняється від початкового, дорівнює:
 (1.32)
(1.32)
Тепловий ефект хімічної реакції
Вихідними даними для розрахунку теплового ефекту реакції
 (1.33)
(1.33)
служать теплоти освіти (  i речовин, що беруть участь у реакції:
i речовин, що беруть участь у реакції:
 (1.34)
(1.34)
Якщо всередині інтервалу температур один або кілька компонентів реакції відчувають фазові перетворення, температурний інтервал розбивають на кілька частин:
Теплота перетворення Нпр береться зі своїм або протилежним знаком залежно від приналежності до продуктів реакції або вихідних речовин.
Ентропія реакції при температурі Трозраховується за формулою
 (1.36)
(1.36)

За наявності фазових переходів інтервал інтегрування розбивається окремі ділянки:
Вважаючи, що теплоємність описується поліномом виду  можна отримати, що
можна отримати, що

Оцінка термодинамічної можливості протікання реакції
Для типових умов протікання хімічної реакції ( Т= const, Р= const) термодинамічна можливість протікання реакції визначається знаком зміни значення енергії Гіббса Gсистеми під час проходження реакції. Реакція протікає, якщо G< 0.
Використовуючи дані (стандартні теплоти освіти (ентальпії), ентропії теплоємності або наведені потенціали, що наводяться в довідниках, по термодинамічних властивостях речовин можна легко розрахувати зміну стандартного потенціалу Гіббса, коли за початковий стан приймаються умови, що всі вихідні тиски дорівнюють 1 атм
 . (1.40)
. (1.40)
У принципі, цю характеристику можна використовувати для оцінки термодинамічної ймовірності реакції. Однак до такої оцінки слід підходити з обережністю, тому що початкові тиски в реальних системах рідко дорівнюють 1 атм.
Абсолютно достовірною характеристикою можливості протікання реакції за довільних початкових умов служить справжня зміна потенціалу Гіббса, пов'язана зі зміною стандартного потенціалу рівнянням ізотерми хімічної реакції:

де K p – константа рівноваги реакції, а парціальний тиск p" i відносяться до продуктів реакції, а p i - До реагентів.
У загальному випадку знак  може не збігатися зі знаком
може не збігатися зі знаком  .
.
Позитивне значення зміни стандартної енергії Гіббса вказує не абсолютну неможливість реакції, а лише на незначний або дуже малий вихід продуктів у стандартному стані. Наявність другого складового у правій частині рівняння ізотерми свідчить про те, що значного виходу продуктів можна досягти навіть за позитивних значень зміни стандартної енергії Гіббса. Це станеться з допомогою створення у системі певного співвідношення між тисками учасників реакції.
Термодинамічна можливість протікання реакції слід відрізняти від її практичної можливості , Під якою мають на увазі протікання реакції з помітною швидкістю. Наявність кінетичних труднощів може стати перешкодою для проведення реакції необхідною швидкістю. Таким чином, термодинамічна можливість реакції означає лише принципову здійсненність реакції, можливість її мимовільного перебігу в умовах, що розглядаються, але не гарантує кінцеву швидкість перетворення вихідних речовин в продукти.
Хімічна термодинаміка вивчає енергетичні ефекти реакцій, їх напрямок та межі мимовільного перебігу.
Об'єкт вивчення у хімічній термодинаміці – термодинамічна система (надалі просто система) – це сукупність взаємодіючих речовин, подумки чи реально відокремлена від навколишнього середовища.
Система може бути в різних станах. Стан системи визначається чисельними значеннями термодинамічних параметрів:температури, тиску, концентрацій речовин та ін. При зміні значення хоча б одного з термодинамічних параметрів, наприклад температури відбувається зміна стану системи. Зміна стану системи називається термодинамічний процес або просто процесом.
Процеси можуть протікати з різними швидкостями. Залежно від умов переходу системи з одного стану в інший, у хімічній термодинаміці розрізняють кілька типів процесів, найпростішими з яких є ізотермічний, що протікає при постійній температурі (Т=соnst), ізобарний, що протікає при постійному тиску (р=соnst), ізохорний, протікає при постійному об'ємі (V=соnst) та адіабатичний, який здійснюється без обміну теплотою між системою та навколишнім середовищем (q=соnst). Найчастіше в хімічній термодинаміці реакції розглядаються як ізобарно-ізотермічні (р = соnst, Т = соnst) або ізохорно-ізотермічні (V = соnst, Т = соnst) процеси.
Найчастіше у хімічній термодинаміці розглядаються реакції, які притікають у стандартних умовах, тобто. при стандартній температурі та стандартному стані всіх речовин . В якості стандартної прийнята температура 298К. Стандартним станом речовини є стан при тиску 101,3 кПа. Якщо речовина знаходиться в розчині, за стандартний приймається її стан при концентрації 1 моль/л.
Для характеристики процесів хімічна термодинаміка оперує особливими величинами, званими функціями стану: U – внутрішня енергія, Н – ентальпія, S – ентропія, G – енергія Гіббса та F – енергія Гельмгольця. Кількісними характеристиками будь-якого процесу є зміни функцій стану, які й визначаються методами хімічної термодинаміки: U, H, S, G, F.
Термохімічний розрахунок полягає у визначенні теплового ефекту реакції (теплоти реакції). Теплотою реакції, називається кількість виділеної або поглиненої теплоти q .Якщо в ході реакції теплота виділяється, така реакція називається екзотермічною, якщо теплота поглинається, реакція називається ендотермічною.
Чисельне значення теплоти реакції залежить від способу проведення. У ізохорному процесі, що проводиться при V=соnst , теплота реакції q V = Δ U, в ізобарному процесі при р = соnst тепловий ефект q p = Δ H. Таким чином, термохімічний розрахунок полягає у визначенні величини зміни або внутрішньої енергії, або ентальпії в ході реакції. Оскільки переважна більшість реакцій протікає в ізобарних умовах (наприклад, це всі реакції у відкритих судинах, що протікають під атмосферним тиском), під час проведення термохімічних розрахунків практично завжди проводиться розрахунок ΔН. Якщо Δ Н<0, то реакция экзотермическая, если же Δ Н>0, то ендотермічна реакція.
Термохімічні розрахунки проводяться, використовуючи слідство із закону Гесса : тепловий ефект реакції дорівнює сумі теплот (ентальпій) утворення продуктів реакції за вирахуванням суми теплот (ентальпій) утворення реагентів.
Запишемо у загальному вигляді рівняння реакції: аА + bВ = сС + dD. Відповідно до слідства із закону Гесса теплота реакції визначається за формулою:
Δ Н = (cΔ Н обр, З + dΔ Н обр, D) - (аΔ Н обр, А + bΔ Н обр, В),деΔ Н -теплота реакції; ΔН обр – теплоти (ентальпії) утворення, відповідно, продуктів реакції С та D та реагентів А та В; с, d, а, b – коефіцієнти рівняння реакції, звані стехиометрическим і коефіцієнтами.
Базовими величинами у цій формулі є теплоти (ентальпії) утворення реагентів та продуктів. Теплотою (ентальпією) утворення сполуки називається тепловий ефект реакції, в ході якої утворюється 1 моль цієї сполуки з простих речовин, що знаходяться в термодинамічно стійких фазах та модифікація . Наприклад, теплота утворення води в пароподібному стані дорівнює половині теплоти реакції, що виражається рівнянням: 2Н2(г) + О2(г) = 2Н2О(г). Розмір теплоти освіти – кДж/моль.
У термохімічних розрахунках теплоти реакцій, як правило, визначаються для стандартних умов, для яких формула набуває вигляду: ΔН ° 298 = (cΔН ° 298 обр С + dΔН ° 298 обр D) - (аΔН ° 298 о6р A + bΔН ° 298 обр В ), де ΔН° 298 – стандартна теплота реакції в кДж (стандартність величини вказується верхнім індексом "Про") при температурі 298К, а ΔН° 298 обр. - стандартні теплоти (ентальпії) утворення сполук також за температури 298К. Значення ΔН° 298обр. визначені всім сполук і є табличними даними.
Енергією Гіббса реакції називається зміна енергії ГіббсаΔ G при перебігу хімічної реакції. Оскільки енергія Гіббса системи G = Н – ТS, її зміна у процесі визначається за такою формулою: Δ G = Δ Н - ТΔ S,де Т – абсолютна температура, До.
Енергія Гіббса хімічної реакції характеризує можливість її мимовільного перебігу при постійному тиску та температурі (при р = соnst, Т = соnst). Якщо Δ G< 0, то реакция может протекать самопроизвольно, при Δ G > 0 мимовільне перебіг реакції неможливо, якщо Δ G = 0, система перебуває у стані рівноваги.
Для розрахунку енергії Гіббса реакції окремо визначаються ΔН та ΔS. При цьому в більшості випадків використовується слабка залежність величин зміни ентальпії ΔН та ентропії ΔS від умов перебігу реакції, тобто. користуються наближеннями: ΔН = ΔН° 298 і ΔS = ΔS° 298 .
Стандартну теплоту реакції ΔН° 298 визначають, використовуючи слідство із закону Гесса, а стандартну ентропію реакції аА + bВ = сС + dD розраховують за формулою: ΔS° 298 = (сS° 298 обрС + dS° 298, обр D) – (aS° 298 обрА + bS° 298 обр B), де ΔS° 298 – табличні значення абсолютних стандартних ентропії сполук у Дж/(мольК), а ΔS° 298 – стандартна ентропія реакції у Дж/К.
Якщо реакція протікає в стандартних умовах за температури 298К, розрахунок її енергії Гіббса (стандартної енергії Гіббса реакції) можна проводити аналогічно розрахунку стандартної теплоти реакції за формулою, яка для реакції, вираженої рівнянням аА + bВ = сС + dD, має вигляд:
ΔG ° 298 =(сΔG ° 298 С + dΔG ° 298 D) – (аΔG ° 298 A + bΔG ° 298 B), де ΔG ° 298 - стандартна енергія Гіббсу утворення з'єднанняу кДж/моль (табличні значення) – енергія Гіббса реакції, в якій при температурі 298К утворюється 1 моль даної сполуки, що знаходиться в стандартному стані, з простих речовин, що також знаходяться в стандартному стані,а ΔG ° 298 - стандартна енергія Гіббса реакції в кДж.
Завдання 1.Для цієї реакції 2SO 2 (г)+ O 2 (г) = 2SO 3 (г) розрахуйте зміну ентальпії ΔН 298 , ентропії ΔS 298 та енергії Гіббса ΔG 298 . Розрахуйте температурну ділянку мимовільного перебігу реакції. Розрахуйте константу рівноваги даної реакції за стандартних умов (таблиці стандартних термодинамічних потенціалів наводяться у різних довідниках).
Розрахунок ентальпії (ΔН 298°):
Δ Н ° 298 =Σ Δ Н продуктів реакції – Σ Δ Н реагентів
з додатка Таблиці стандартних термодинамічних потенціалів вибираємо значення Δ Н ° 298 для речовин, що беруть участь у реакції та підставляємо їх у розрахункову формулу:
Δ Н ° 298 =Σ Δ Н продуктів реакції – Σ Δ Н реагентів = 2 ∙ Δ Н 298 ° (SO 3) –(2 ∙ Δ Н 298 ° (SO 2) + Δ Н 298 ° (O 2))= = 2 (−395,2) −(2 (−296,9) + 0) = − 197,2 кДж/моль
Розрахунок ентропії (ΔS ° 298):
ΔS ° 298 =Σ Δ S продуктів реакції – Σ Δ S реагентів
з таблиці стандартних термодинамічних потенціалів вибираємо значення ΔS ° 298 для речовин, що беруть участь у реакції та підставляємо їх у розрахункову формулу:
ΔS ° 298 =Σ Δ S продуктів реакції – Σ Δ S реагентів = 2∙ ΔS ° 298 (SO 3) -(2∙ΔS ° 298 (SO 2)+ ΔS ° 298 (О 2)) =
=2∙ 256,2 – (2∙248,1 +205) = –188,8 = –0,1888 .
Розрахунок енергії Гіббса (ΔG°298):
Δ G ° 298 = Δ Н ° 298 – T∙ ΔS ° 298
за отриманими даними розраховуємо енергію Гіббса (за стандартних умов Т = 298К):
Δ G ° 298 = Δ Н ° 298 –T∙ΔS ° 298 =−197,2кДж/моль – 298∙(–0,1888) = –140,9 кДж/моль.
Розрахунок показує, що окислення діоксиду сірки киснем при 25ºC (298K) термодинамічно можливий процес (т.к. ∆G<0). В ходе этой реакции энтропия уменьшается и, следовательно, с ростом температуры уменьшается возможность протекания этой реакции.
Визначення температурної області мимовільного перебігу реакції.
Оскільки умовою мимовільного перебігу реакції є негативність DG (DG<0), определение области температур, в которой реакция может протекать самопроизвольно, сводится к решению неравенства (DH–TDS)<0 относительно температуры.
Теоретичні відомості
Хімічний процес можна як перший щабель при сходженні від хімічних об'єктів – електрон, протон, атом – до живої системі.
Вчення про хімічні процеси- Це область науки, в якій існує найбільш глибоке взаємопроникнення фізики, хімії, біології. В основі цього вчення знаходяться хімічна термодинаміка та кінетика.
Здатність речовини піддаватися хімічним перетворенням визначається їх реакційною здатністю, тобто. природою реагуючих речовин – складом, будовою, характером хімічного зв'язку; енергетичними факторами, що визначають можливість перебігу процесу та кінетичними факторами, що визначають швидкість його протікання.
Майже всі хімічні процеси супроводжуються виділенням чи поглинанням енергії, найчастіше у формі теплоти та роботи.
Теплота –кількісний захід безладного хаотичного руху частинок, що утворюють цю систему.
Робота –кількісний захід упорядкованого руху частинок у спрямованому силовому полі.
Розділ хімії, що вивчає переходи енергії з однієї форми в іншу при хімічних реакціях і встановлює напрямок і межі їх мимовільного перебігу за заданих умов, називається хімічною термодинамікою .
Об'єктом вивчення хімічної термодинаміки є хімічна система.
Система –це тіло, що вивчається, або група тіл, які взаємодіють між собою і подумки або реально відокремлені від навколишнього середовища межами, що проводять або не проводять тепло.
Залежно від характеру взаємодії системи з довкіллям розрізняють відкриті, закриті та ізольованісистеми.
Відкриті системиможуть обмінюватися з навколишнім середовищем енергією та речовиною. Наприклад, водний розчин хлориду натрію, що знаходиться у відкритій посудині. При випаровуванні води з розчину та при теплообміні будуть змінюватися маса системи та її температура, а отже, і енергія.
Закриті системине обмінюються з довкіллям речовиною. Наприклад, розчин хлориду натрію у закритій посудині. Якщо розчин і навколишнє середовище мають різну температуру, то відбуватиметься нагрівання або охолодження розчину, а отже, змінюватиметься його енергія.
Ізольовані системине можуть обмінюватися із середовищем ні речовиною, ні енергією. Ізольована система – це ідеалізація. У природі таких систем немає. Але, незважаючи на неможливість практичного втілення, ізольовані системи дозволяють визначати максимальні теоретичні різниці енергій між системою та її оточенням.
Стан системи визначається сукупністю властивостей та характеризується термодинамічні параметри : температурою (), тиском (), об'ємом (), щільністю (), кількістю речовини (), роботою (), теплотою (). Зміна хоча б одного термодинамічного параметра призводить до зміни стану системи загалом. Якщо всі параметри постійні в часі та просторі, такий стан системи називається рівноважним .
У термодинаміки властивості системи розглядаються в її рівноважних станах: початкових та кінцевих, незалежно від шляху переходу системи з одного стану до іншого. Перехід системи з одного стану в інший при = constназивається ізобарно-ізотермічним,при , = const– ізохорно-ізотермічним.
Найважливішими завданнями хімічної термодинаміки є з'ясування можливості або неможливості мимовільного перебігу процесу тієї чи іншої хімічної реакції за умов і в заданому напрямку; встановлення значення термодинамічних параметрів, у яких досягається максимальний вихід процесу; визначення характеристик енергетичної зміни, що відбувається у системі. Знаходять це за допомогою термодинамічні функції ().
Функція стану характеризує внутрішню енергію системи – суму потенційної енергії взаємодії всіх частинок тіла між собою та кінетичної енергії їх руху. Вона залежить стану речовини – виду, маси, агрегатного стану. Абсолютну величину внутрішньої енергії виміряти неможливо. Для вивчення хімічних процесів важливо знати лише зміну внутрішньої енергії під час переходу системи з одного стану до іншого.
 (27)
(27)
При цьому  внутрішня енергія системи зменшується, при
внутрішня енергія системи зменшується, при  - Зростає. Всі зміни внутрішньої енергії відбуваються за рахунок хаотичного зіткнення молекул (заходом енергії, що передається таким способом енергії є теплота) і переміщення мас, що складаються з великої кількості частинок, під дією будь-яких сил (заходом енергії, що передається таким способом, є робота). Таким чином, передача внутрішньої енергії може здійснюватися частково у вигляді теплоти і частково у вигляді роботи:
- Зростає. Всі зміни внутрішньої енергії відбуваються за рахунок хаотичного зіткнення молекул (заходом енергії, що передається таким способом енергії є теплота) і переміщення мас, що складаються з великої кількості частинок, під дією будь-яких сил (заходом енергії, що передається таким способом, є робота). Таким чином, передача внутрішньої енергії може здійснюватися частково у вигляді теплоти і частково у вигляді роботи:
 (28)
(28)
Наведене рівняння є математичним виразом I закону термодинаміки : якщо до системи підвести тепло, то підведене тепло витрачається збільшення внутрішньої енергії системи і скоєння їй роботи.
У ізохорно-ізотермічному процесі вся теплота, підведена до системи, витрачається зміну внутрішньої енергії:
 (29)
(29)
В ізобарно-ізотермічному процесі єдиним видом роботи, що здійснюється системою, є робота розширення:
 (30)
(30)
де - тиск у системі, - зміна обсягу
Тоді математичний вираз I закону термодинаміки набуває вигляду:  (31)
(31)
Позначивши  , отримуємо
, отримуємо 
Функція стану системи Н – ентальпія – це загальний запас енергії системи, тобто. це енергозміст системи. Ентальпія системи більша за внутрішню енергію на величину роботи.
Для характеристики енергетичних проявів у ході реакції запроваджено поняття тепловий ефект.
Тепловий ефект– це кількість теплоти, що виділяється чи поглинається при незворотному перебігу реакції, коли єдиною роботою буде робота розширення. При цьому температури вихідних речовин та продуктів реакції мають бути однаковими. Тепловий ефект ендотермічної реакції(Протікає з поглинанням тепла) буде позитивним:  ,
,  . Тепловий ефект екзотермічної реакції(Протікає з виділенням тепла) буде негативним:
. Тепловий ефект екзотермічної реакції(Протікає з виділенням тепла) буде негативним:  ,
,  .
.
Розділ хімії, присвячений вивченню теплових ефектів хімічних реакцій, називається термохімією .
Будь-яка хімічна реакція супроводжується змінами запасу енергії речовин, що реагують. Чим більше енергії виділилося при утворенні будь-якої хімічної сполуки, тим ця сполука стійкіша, і, навпаки, речовина, отримана в результаті ендотермічної реакції, нестійка.
У хімічних рівняннях, у яких вказано теплоту реакції, називаються термохімічними.Вони складаються на основі законів збереження маси та енергії.
Для порівняння теплових ефектів різних процесів стандартизують умови їхнього протікання. Стандартні умови - Т 0 = 298 К, р 0 = 101,313 кПа, n - 1 моль чистої речовини, зміна ентальпії (  ) відносять до одиниці кількості речовини, кДж/моль. Усі стандартні термодинамічні функції – це табличні величиниякі залежать від агрегатного стану речовини.
) відносять до одиниці кількості речовини, кДж/моль. Усі стандартні термодинамічні функції – це табличні величиниякі залежать від агрегатного стану речовини.
З I закону термодинаміки випливають кількісні закони термохімії.
Закон Лавуазьє-Лапласа(1780 – 1784) – кожному за хімічного з'єднання теплота розкладання дорівнює теплоті його освіти, але має протилежний знак.
Закон Г.І. Гесса(1840) – тепловий ефект хімічної реакції залежить від природи та фізичного стану вихідних речовин та кінцевих продуктів, але не залежить від характеру та шляху протікання реакції, тобто. від послідовності окремих проміжних стадій.Цей закон – теоретична основа термохімії. З нього випливає низка наслідків:
У термохімічних розрахунках теплота освіти (ентальпія) простих речовин у стандартних умовах приймається рівною нулю.
 (простої речовини) = 0
(простої речовини) = 0
Кількість енергії, що виділяється або поглинається при утворенні 1 моль складної речовини із простих у стандартних умовах, називається стандартною ентальпією освіти (  , кДж/моль).
, кДж/моль).
Кількість енергії, що виділяється або поглинається 1 моль органічної речовини, що розкладається до вуглекислого газу і води в стандартних умовах, називається стандартною ентальпією згоряння (  , кДж/моль).
, кДж/моль).
Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції та сумою теплот утворення вихідних речовин з урахуванням стехіометричних коефіцієнтів:
де – тепловий ефект хімічної реакції у стандартних умовах;  - сума стандартних теплот утворення продуктів реакції;
- сума стандартних теплот утворення продуктів реакції;  - сума стандартних теплот утворення вихідних речовин;
- сума стандартних теплот утворення вихідних речовин;  ,
,  - стехіометричні коефіцієнти відповідно продуктів реакції та вихідних речовин.
- стехіометричні коефіцієнти відповідно продуктів реакції та вихідних речовин.
Закон Гесса дозволяє розрахувати теплові ефекти різних реакцій. Але знак і величина теплового ефекту не дозволяє судити про здатність процесів до мимовільного перебігу і не містить інформації про напрям і повноту перебігу процесів.
Мимовільні процеси(природні або позитивні) – протікають у системі без втручання з боку зовнішнього середовища та супроводжуються зменшенням внутрішньої енергії системи та передачею енергії у навколишнє середовище у формі теплоти та роботи. Ендотермічні мимовільні процеси не суперечать цьому визначенню, оскільки вони можуть протікати в неізольованій системі та виконувати роботу за рахунок теплоти навколишнього середовища.
Процеси, які самі собою (без зовнішнього впливу) відбуватися не можуть, називаються мимовільними , неприродними чи негативними. Такі процеси здійснюються шляхом передачі системі енергії із зовнішнього середовища у формі теплоти чи роботи.
Згідно з II законом термодинаміки мимовільні процеси йдуть у бік зменшення запасу внутрішньої енергії або ентальпії системи. Проте відомі такі процеси, які протікають мимовільно без зміни внутрішньої системи. Рушійною силою таких процесів є ентропія системи.
Ентропія(пов'язана енергія) (
S)
- Це міра незворотності процесу, міра переходу енергії в таку форму, з якої вона не може самостійно в іншу енергію. Ентропія характеризує безлад у системі, що вищий безлад, то вища ентропія. Вона зростає із збільшенням руху частинок. У ізольованих від довкілля системах процеси протікають мимовільно у бік збільшення ентропії (). Процеси, для яких ентропія зменшується (  ) Неможливі в ізольованих системах. Якщо процес можливий у прямому та зворотному напрямках, то в ізольованій системі він протікатиме у напрямку зростання ентропії. Протікання мимовільного процесу в ізольованій системі завершується станом рівноваги. Отже, у стані рівноваги ентропія системи максимальна
.
) Неможливі в ізольованих системах. Якщо процес можливий у прямому та зворотному напрямках, то в ізольованій системі він протікатиме у напрямку зростання ентропії. Протікання мимовільного процесу в ізольованій системі завершується станом рівноваги. Отже, у стані рівноваги ентропія системи максимальна
.
Больцман вивів рівняння, згідно з яким
(34) де - постійна Больцмана, W - ймовірність стану, визначає кількість мікростанів, що відповідають даному мікростану.
Це співвідношення показує, що ентропію можна як міру молекулярного безладдя системи.
Відповідно до II закону термодинаміки для ізотермічного процесу зміна ентропії дорівнює:
 ; [Дж/(моль·К] (35)
; [Дж/(моль·К] (35)
Ентропія простих речовин не дорівнює нулю. На відміну від ентальпії, можна виміряти абсолютне значення ентропії. "При абсолютному нулі ентропія ідеального кристала дорівнює нулю" - цей постулат М. Планка (1911 р) називають ІІІ законом термодинаміки.
Зміна ентропії хімічного процесу визначається балансовим рівнянням:
Будь-яка система характеризується порядком () та безладдям (). Їх співвідношення визначає напрямок протікання реакції.
Таким чином, при мимовільному русі системи до сталого стану виявляються дві тенденції: зменшення ентальпії  та зростання ентропії. Сумарний ефект двох тенденцій при постійній температурі та тиску відображає ізобарно-ізотермічний потенціал або енергія Гіббса ()
.
та зростання ентропії. Сумарний ефект двох тенденцій при постійній температурі та тиску відображає ізобарно-ізотермічний потенціал або енергія Гіббса ()
.
Функція стану
характеризує загальну рушійну силу процесу, максимально можливу корисну роботу («вільна енергія»), що здійснюється системою;  - частина енергії, яка може бути перетворена на корисну роботу («пов'язана енергія»).
- частина енергії, яка може бути перетворена на корисну роботу («пов'язана енергія»).
Хімічні реакції протікають у відкритій посудині зі зміною об'єму, тому можливість (самовільність) та напрямок процесу характеризує функція , що визначається за балансовим рівнянням за стандартних умов:
;  (38)
(38)
Мимовільному перебігу процесу відповідає зменшення енергії Гіббса,  . Чим більше зменшується, тим більше необоротно протікає процес у бік утворення кінцевих продуктів реакції. Збільшення ізобарного потенціалу
. Чим більше зменшується, тим більше необоротно протікає процес у бік утворення кінцевих продуктів реакції. Збільшення ізобарного потенціалу  є ознакою нездійсненності процесу у даних умовах. Значення
є ознакою нездійсненності процесу у даних умовах. Значення  характеризує стан рівноваги, тобто. стан, у якому система не робить корисної роботи.
характеризує стан рівноваги, тобто. стан, у якому система не робить корисної роботи.
Аналіз величин і рівнянні Гіббса показав, що можливість оборотного перебігу процесу обумовлена однаковими знаками і . При певній температурі величини та  стають рівними. Тому з рівняння Гіббса можна визначити «рівноважну» температуру або температуру початку процесу ():
стають рівними. Тому з рівняння Гіббса можна визначити «рівноважну» температуру або температуру початку процесу ():
 ; = 0
;
; = 0
;  ;
;  (39)
(39)
Таким чином, мимовільно протікають реакції, в яких зміна вільної енергії є негативною. Реакції, у яких  , Протікають лише за умови, що над системою буде виконана робота зовнішніми силами або системі буде передана енергія ззовні. Умови мимовільного перебігу процесу показано на рис. 3.
, Протікають лише за умови, що над системою буде виконана робота зовнішніми силами або системі буде передана енергія ззовні. Умови мимовільного перебігу процесу показано на рис. 3.
Хімічні реакції, Хімічні реакції,
ті, що протікають мимоволі, що протікають не мимоволі


екзотермічні реакції, екзотермічні реакції,
супроводжуються супроводжуються
зростанням ентропії зменшенням ентропії
при будь-якихтемпературах при високихтемпературах
ендотермічні реакції
супроводжуються
зростанням ентропії
при низькихтемпературах
Мал. 3. Умови мимовільного перебігу процесу.
3.2. Контрольні питання та завдання
1. Що називається системою? Якими параметрами характеризується система?
2. Охарактеризуйте внутрішню енергію системи, поняття про ізохорні та ізобарні процеси.
3. Що називається ентальпією?
4. Охарактеризуйте ентальпію утворення сполук, стандартні ентальпії згоряння та утворення речовин.
5. Закон Гесса та його наслідки, його застосування у термохімічних розрахунках.
6. Визначення теплот (ентальпій) нейтралізації, розчинення, гідратації.
7. Ентропія. Рівняння Больцмана. Як змінюється ентропія із зміною температури?
8. Енергія Гіббса. Критерії мимовільного перебігу процесу.
9. Користуючись довідковими даними додатка 3, обчисліть зміну стандартної ентальпії реакції ():
10. Користуючись довідковими даними додатка 3, обчисліть зміну стандартної ентропії реакції (  ):
):
11. Обчислити реакції при 846 0 С, якщо = 230 кДж,  = 593 Дж/К.
= 593 Дж/К.
Приклади розв'язання задач
приклад 1.Реакція горіння етилового спирту виражається термохімічним рівнянням З 2 Н 5 ОН (Ж) + 3О 2(Г) = 2СО 2(Г) + 3Н 2 О (Ж) . Обчисліть тепловий ефект реакції, якщо відомо, що молярна теплота пароутворення З 2 Н 5 ВІН (Ж) дорівнює +42,36 кДж, а теплоти утворення З 2 Н 5 ВІН (Г) = -235,31 кДж, 2 (Г) = -393,51 кДж, Н2О(Ж) = -285,84 кДж.
Рішення.Для визначення ΔΗ реакції необхідно знати теплоту утворення 2 Н 5 ВІН (Ж) . Останню знаходимо з даних:
З 2 Н 5 ВІН (Ж) = З 2 Н 5 ВІН (Г); ΔΗ = +42,36 кДж
42,36 = -235,31 - ΔΗ(З 2 Н 5 ВІН (Ж))
ΔΗ(З 2 Н 5 ВІН (Ж)) = -235,31-42,36 = -277,67 кДж
Обчислюємо ΔΗ реакції, застосовуючи наслідки із закону Гесса:
ΔΗ Х.Р. = 2 (-393,51) + 3 (-285,84) + 277,67 = -1366,87 кДж.
Тепловий ефект реакції 1366,87 кДж.
а) Fe 2 O 3(К) + 3H 2(Г) = 2Fe (К) + 3H 2 O(Г)
б) Fe 2 O 3(К) + 3СО(Г) = 2Fe(К) + 3СО 2(Г)
У якому разі на цей процес потрібно більше витратити енергію?
Рішення.Для розрахунку ΔΗ ХР скористаємося формулою слідства із закону Гесса та стандартними ентальпіями утворення кожної речовини [Додаток 3]:
а) ΔΗ ХР = 2ΔΗ(Fe) + 3ΔΗ(H 2 O) – (ΔΗ(Fe 2 O 3) + 3ΔΗ(H 2)) = 2(0) + 3(-241,8) – ((-822 ,2) + 3 (0)) = -725,4 + 822,2 = 96,8 кДж.
б) ΔΗ ХР = 2ΔΗ(Fe) + 3ΔΗ(З 2) – (ΔΗ(Fe 2 O 3) + 3ΔΗ(СО)) = 2(0) + 3(-393,5) – ((-822,2) ) + 3(-110,5)) = -1180,5 + 822,2 + 331,5 = -26,5 кДж.
Згідно з розрахунками, процес а) – відновлення оксиду заліза (III) воднем, що вимагає більше витрат енергії, ніж процес б). У процесі б) реакція навіть має екзотермічний характер (виділяється енергія у вигляді тепла).
приклад 3.Водяний газ є сумішшю рівних обсягів водню і оксиду вуглецю (II). Знайдіть кількість теплоти, що виділяється при спалюванні 112 л водяного газу (н.у.).
Рішення.Складемо термохімічне рівняння процесу:
Н 2(Г) + СО (Г) + О 2(Г) = Н 2 О (Г) + СО 2(Г) ΔΗ ХР = - Q.
Розрахуємо ΔΗ ХР, коли згоряє 2 моля водяного газу (1 моль Н 2 і моль СО), тобто. 22,4 л/моль · 2 моль = 44,8 л. Розрахунок ведемо за формулою наслідку закону Гесса та стандартними ентальпіями утворення кожної речовини [Доп. 3]:
ΔΗ ХР = ΔΗ(Н 2 О) + ΔΗ(СО 2) – (ΔΗ(Н 2) + ΔΗ(СО) + ΔΗ(О 2)) = -241,8 – 393,5 – (0 – 110,5 + 0) = - 635,3 + 110,5 = - 524,8 кДж
Складаємо пропорцію:
Згоряє 44,8 л водяного газу - виділяється 524,8 кДж тепла
112 л - Х кДж
Х = 112 · 524,8 / 44,8 = 1312 кДж
При спалюванні 112 л водяного газу виділяється 1312 кДж тепла.
приклад 4.Дайте термодинамічні характеристики процесу Ga + HCl) ↔ GaCl 3(т) + Н 2(г) за планом:
1. Запишіть стехіометричне рівняння.
2. Випишіть термодинамічні функції речовин, що беруть участь.
3. Розрахуйте зміну стандартної ентальпії хімічної реакції та побудуйте ентальпійну діаграму.
4. Визначте, чи є реакція екзо- або ендотермічної; збільшується або зменшується температура в системі внаслідок перебігу цієї реакції.
5. Розрахуйте зміну стандартної ентропії реакції, поясніть зміну ентропії під час реакції.
6. Розрахуйте стандартну зміну енергії Гіббса за балансовим рівнянням та рівнянням Гіббса. Дайте аналіз отриманим даним.
7. Зіставте знаки величин  . і
. і  Зробіть висновок про оборотність реакції.
Зробіть висновок про оборотність реакції.
8. Для оборотної реакції розрахуйте рівноважну температуру відповідно до рівняння Гіббса припускаючи, що гранично допустимою температурою є 3000 К. Зробіть висновок: Тр – реалізована або реалізована.
9. Розрахуйте величину  при трьох значеннях температур (500, 1000 та 1500 К). Побудуйте графічну залежність
при трьох значеннях температур (500, 1000 та 1500 К). Побудуйте графічну залежність  ..
..
10. Зробіть висновок про мимовільність перебігу хімічної реакції. Визначте умови, за яких реакція можлива
Рішення.
1 Записуємо стехіометричне рівняння.
2. Виписуємо стандартні термодинамічні функції утворення компонентів реакції (табл. 21) (термодинамічні параметри речовин [Додаток 3]).